| Холинацетилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.6 | ||||||||
| Номер CAS | 9012- 78-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Представление IntEnz | ||||||||
| BRENDA | Запись BRENDA | ||||||||
| ExPASy | Представление NiceZyme | ||||||||
| KEGG | Запись KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| PRIAM | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Онтология генов | AmiGO / QuickGO | ||||||||
| |||||||||
| CHAT | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||
| Псевдонимы | CHAT, CHOACTASE, CMS1A, CMS1A2, CMS6, холин-O-ацетилтрансфераза | |||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 118490 MGI : 88392 HomoloGene: 40693 GeneCards: CHAT | |||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Orthologs | ||||||||||||||||||||||||||
| Виды | Человек | Мышь | ||||||||||||||||||||||||
| Entrez | ||||||||||||||||||||||||||
| Ensembl | ||||||||||||||||||||||||||
| UniP гниль | ||||||||||||||||||||||||||
| RefSeq (мРНК) |
Холина ацетилтрансфераза (обычно сокращенно ChAT, но иногда CAT ) - это трансфераза фермент, ответственный за синтез нейромедиатора ацетилхолин. ChAT катализирует перенос ацетильной группы от кофермента ацетил-CoA на холин с образованием ацетилхолина (ACh). ChAT обнаруживается в высокой концентрации в холинергических нейронах, как в центральной нервной системе (ЦНС), так и в периферической нервной системе (ПНС).. Как и большинство белков нервных окончаний, ChAT продуцируется в теле нейрона и транспортируется к нервному окончанию, где его концентрация наиболее высока. Присутствие ChAT в нервной клетке классифицирует эту клетку как «холинергический» нейрон. У человека фермент холинацетилтрансфераза кодируется геном CHAT . Содержание
ИсторияХолинацетилтрансфераза была впервые описана Дэвидом Нахмансоном и А.Л. Мачадо в 1943 году. Немецкий биохимик Нахмансон изучал процесс проведение нервных импульсов и использование энергосберегающих химических реакций в клетках, расширяя работы нобелевских лауреатов Отто Варбурга и Отто Мейерхоф о ферментации, гликолиз и сокращение мышц. Основываясь на предшествующих исследованиях, показывающих, что «действие ацетилхолина на структурные белки» отвечает за нервные импульсы, Нахмансон и Мачадо исследовали происхождение ацетилхолина. Из мозга и нервной ткани был выделен фермент, который образует ацетилхолин. Образование происходит только в присутствии аденозинтрифосфата (АТФ). Фермент называется холинацетилазой. — Nachmanson Machado, 1943Механизм действия ацетил трансферазы был неизвестен во время этого открытия, однако Нахмансон предположил возможность ацетилфосфата или фосфорилхолина с заменой фосфата (из ATP ) на холин или ацетат-ион. Лишь в 1945 году Коэнзим A (CoA) был открыт одновременно и независимо в трех лабораториях, одной из которых была лаборатория Нахмансона. Впоследствии в 1951 году был открыт ацетил-КоА, в то время называемый «активным ацетатом». Трехмерная структура ХАТ, полученного от крысы, не была решена почти 60 лет спустя, в 2004 году. СтруктураТрехмерная структура ChAT была определена с помощью рентгеновской кристаллографии PDB : 2FY2. Холин связывается в активном центре ChAT за счет нековалентных взаимодействий между положительно заряженным амином холина и гидроксильной группой Tyr552, в дополнение к водородной связи между гидроксильной группой холина. и остаток гистидина, His324. Холиновый субстрат помещается в карман внутри ChAT, а ацетил-КоА помещается в карман на поверхности белка. Кристаллическая структура 3D показывает, что ацетильная группа ацетил-КоА примыкает к карману связывания холина - минимизируя расстояние между донором ацетильной группы и приемником.
ГомологияChAT очень консервативен в геноме животных. В частности, у млекопитающих наблюдается очень высокое сходство последовательностей. ChAT человека и кошки (Felis catus), например, имеют 89% идентичности последовательностей. Идентичность последовательности с Drosophila составляет около 30%. Формы ChATСуществуют две формы ChAT: растворимая форма и мембраносвязанная форма. Растворимая форма обеспечивает 80-90% общей активности фермента, в то время как мембраносвязанная форма отвечает за остальные 10-20% активности. Однако уже давно ведутся споры о том, как последняя форма ChAT связывается с мембраной. Мембраносвязанная форма ChAT связана с синаптическими везикулами. Общие и периферические изоформы ChATСуществуют две изоформы ChAT, обе кодируются одной и той же последовательностью. Общий тип ChAT (cChAT) присутствует как в ЦНС, так и в ПНС. ChAT периферического типа (pChAT) преимущественно экспрессируется в PNS у людей и возникает в результате пропуска экзона (экзоны 6-9) во время посттранскрипционной модификации. Следовательно, аминокислотная последовательность очень похожа, однако в pChAT отсутствуют части последовательности, присутствующей в cChAT. Изоформа pChAT была открыта в 2000 году на основании наблюдений, что полученные из мозга ChAT антитела не могут окрашивать периферические холинергические нейроны, как те, что обнаруживаются в головном мозге. Этот механизм сплайсинга генов, который приводит к различиям cChAT и pChAT, наблюдался у различных видов, включая как позвоночных млекопитающих, так и беспозвоночных моллюсков, что позволяет предположить, что этот механизм приводит к некоторым еще неустановленным эволюционным преимуществам. Функция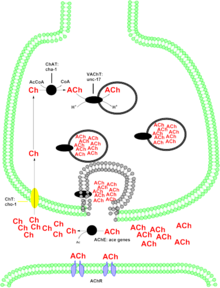 синтез и транспортировка ACh в клетках синтез и транспортировка ACh в клетках Холинергические системы участвуют во многих неврологических функциях. Изменения в некоторых холинергических нейронах могут быть причиной нарушений болезни Альцгеймера. Белок, кодируемый этим геном, синтезирует нейромедиатор ацетилхолин. Ацетилхолин действует на два класса рецепторов в центральной нервной системе - мускариновые и никотиновые, каждый из которых участвует в различных физиологических реакциях. Роль ацетилхолина в никотиновых рецепторах все еще исследуется. Вероятно, он участвует в путях вознаграждения / подкрепления, на что указывает аддиктивная природа никотина, который также связывается с никотиновым рецептором. Мускариновое действие ацетилхолина на ЦНС связано с обучением и памятью. Утрата холинергической иннервации в неокортексе связана с потерей памяти, что подтверждается запущенными случаями болезни Альцгеймера. В периферической нервной системе холинергические нейроны участвуют в контроле висцеральных функций, таких как, помимо прочего, сокращение сердечной мышцы и функция желудочно-кишечного тракта. Он часто используется в качестве иммуногистохимического маркера для мотонейронов (мотонейронов). МутацииМутанты ChAT были выделены у нескольких видов, включая C. elegans, Drosophila и человека. Большинство нелетальных мутантов с фенотипом недикого типа проявляют некоторую активность, но значительно меньшую, чем у дикого типа. У C. elegans несколько мутаций в ChAT были прослежены до гена cha-1. Все мутации приводят к значительному снижению активности ChAT. Процент потери активности в некоторых случаях может превышать 98%. Фенотипические эффекты включают замедленный рост, уменьшение размера, нескоординированное поведение и отсутствие чувствительности к ингибиторам холинэстеразы. Все изолированные чувствительные к температуре мутанты у Drosophila оказались смертельными. Перед смертью пораженные мухи демонстрируют изменение поведения, включая неконтролируемые движения и изменение электроретинограммы активности. Геном человека, ответственным за кодирование ChAT, является CHAT. Мутации в ЧАТ были связаны с врожденным миастеническим синдромом, заболеванием, которое приводит к общей недостаточности двигательной функции и слабости. Другие симптомы включают фатальное апноэ. Было показано, что из десяти выделенных мутантов 1 полностью лишен активности, 8 - со значительным снижением активности, а 1 имеет неизвестную функцию. Клиническое значениеБолезнь АльцгеймераБолезнь Альцгеймера (AD) связана с нарушениями памяти и познания. Концентрации ацетилхолина и ChAT заметно снижаются в неокортексе головного мозга и гиппокампе. Хотя потеря клеток и дисфункция холинергических нейронов считается фактором, способствующим развитию болезни Альцгеймера, это обычно не рассматривается как основной фактор в развитии этого заболевания. Предполагается, что агрегация и отложение белка бета-амилоид нарушает метаболизм нейронов и в дальнейшем повреждает холинергические аксоны в коре и холинергические нейроны в базальных отделах переднего мозга. Амиотрофный. боковой склерозбоковой амиотрофический склероз (БАС) - одно из наиболее распространенных заболеваний двигательных нейронов. Значительная потеря иммунореактивности ChAT обнаруживается при БАС. Предполагается, что холинергическая функция участвует в неконтролируемом повышении концентрации внутриклеточного кальция, причина которого до сих пор остается неясной. ЛекарстваМетилсульфат неостигмина, антихолинэстеразный агент, был использован для воздействия на ChAT. В частности, было показано, что использование неостигмина метилсульфата оказывает положительное влияние на врожденный миастенический синдром. Было показано, что воздействие эстрадиола увеличивает ChAT у самок крыс. См. ТакжеСсылкиДополнительная литератураВнешние ссылки
Последняя правка сделана 2021-05-14 13:44:12
Содержание доступно по лицензии CC BY-SA 3.0 (если не указано иное). | |||||||||||||||||||||||||