 Холестерин
Холестерин  Холестерин модель заполнения пространства
Холестерин модель заполнения пространства Общий синтез холестерина в химии описывает полный синтез сложной биомолекулы холестерина и считается большим научным достижением. Исследовательская группа Роберта Робинсона с Джоном Корнфортом (Оксфордский университет ) опубликовала свой синтез в 1951 году и синтез Роберта Бернса Вудворда с Франц Сондхаймер (Гарвардский университет ) в 1952 году. Обе группы соревновались за первую публикацию с 1950 года: Робинсон начал в 1932 году, а Вудворд - в 1949 году. По словам историка Грега Малхейрна, усилия Робинсона были затруднены. его стиль руководства на микроменеджменте и усилия Вудворда во многом способствовали его хорошие отношения с химической промышленностью. Примерно в 1949 году стероиды, такие как кортизон, производились из природных ресурсов, но были дорогими. Химические компании Merck Co. и Monsanto увидели коммерческие возможности для синтеза стероидов и не только профинансировали Вудворда, но и предоставили ему большие количества определенных химических промежуточных продуктов с пилотных заводов. Усердный труд также помог усилиям Вудворда: одно из промежуточных соединений было названо Кристмастерон, так как оно было синтезировано на Рождество 1950 года Сондхаймером.
Были разработаны и другие схемы холестерина: рацемический холестерин был синтезирован в 1966 году W.S. Джонсон, энантиомер природного холестерина, был описан в 1996 г. Рихновским и Микусом, в 2002 г. Цзян и Кови и снова в 2008 г. Рихновским и Белани.
холестерин представляет собой тетрациклический спирт и разновидность стерола. К стероловому каркасу с группой спирт в положении 3 добавлены 2 метил группы в положениях углерода 10 и 13 и 2-изооктильная группа в положении 17. Молекула является ненасыщенной в положении 5,6 с группой алкена. Общее количество стереоцентров равно 8. Неестественная молекула холестерина, которая также была синтезирована, называется энт-холестерином . 
Синтез Робинсона является примером так называемый релейный синтез. Поскольку многие химические промежуточные соединения (все стероиды) уже были известны и доступны из природных ресурсов, все, что требовалось для формального синтеза, было доказательством того, что эти промежуточные соединения могут быть связаны друг с другом посредством химического синтеза. Отправной точкой для синтеза Робинсона был 1, который был преобразован примерно за 20 шагов в уже известный на тот момент андростерон 4. Ружичка уже продемонстрировал в 1938 году, что андростерон может быть преобразован в андростендион 5, а Робинсон продемонстрировал его преобразование в дегидроэпиандростерон 6(обратите внимание на эпимеризованную гидроксильную группу), также уже известное соединение. Преобразование 6 в прегненолон 7, а затем в аллопрегнанолон 8позволило добавить хвостовую группу в качестве ацетата в 9, а затем преобразовать в холестанол 10.
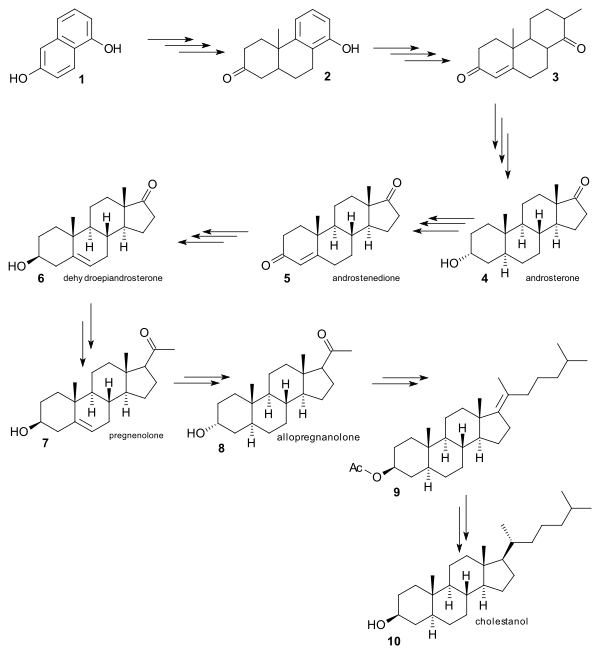
Превращение холестанола в холестерин уже было продемонстрировано окислением кетона бромированием в бромкетон и элиминированием в енон.

Превращение холестенона в холестерин по методу Даубена и Истема (1950) состояло из восстановления енолацетата (литийалюминийгидрид ) и фракционирования с дигитонин для выделения правильного изомера.
Отправной точкой для синтеза Вудворда был гидрохинон 1, который был преобразован в цис-бицикл 2 в Дильс- Реакция Альдера с бутадиеном. Превращение в желаемый транс-изомер 5осуществляли путем синтеза соли енолята натрия 4(бензола, гидрида натрия с последующим подкислением. Восстановление (литийалюмогидрид ) затем дает диол 6, дегидратация (HCl / вода) дает кетолом 7, дезоксигенация его ацетата элементарным цинком дала енон 8, формилирование (этилформиат ) давала енол 9, Добавление Майкла (трет-бутоксид калия / трет-бутанол ) давало дион 11, который при взаимодействии с КОН в диоксан давал трицикл 12 при альдольной конденсации с удалением формильной группы. В следующей серии стадий окисление (тетроксид осмия ) давало диол 13, защиту (ацетон / сульфат меди ) давало ацетонид 14, гидрирование () дало 15, формилирование (этилформиат ) дало енол 16, который защищен как енамин 17(N-метиланилин / метанол ) получают через анион калия 18, карбоновую кислоту 19реакцией с цианоэтиленом с использованием тритона B в качестве основание.
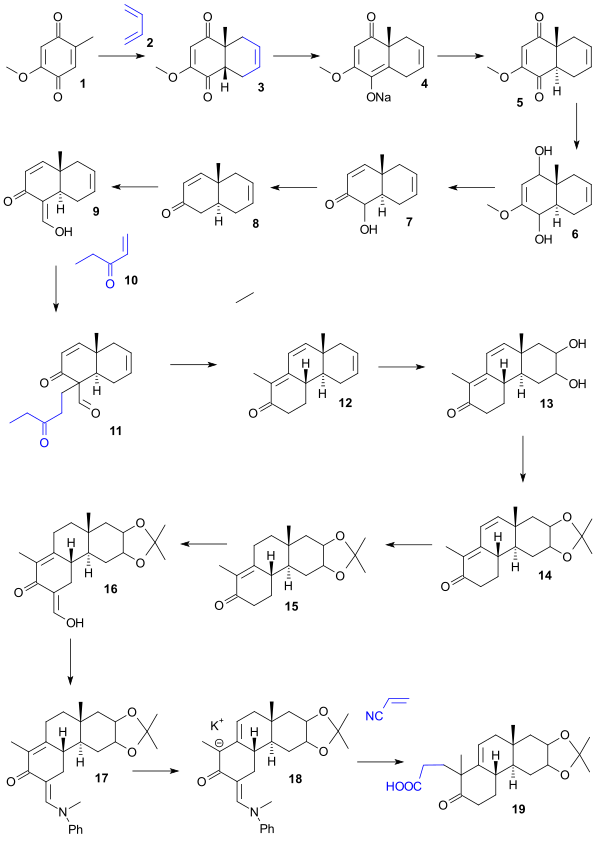
Кислота 19 была преобразована в лактон 20(уксусный ангидрид, ацетат натрия ), и реакция с метилмагнийхлоридом дала тетрациклический кетон 21. Обработка периодной кислотой (диоксаном) и ацетатом пиперидина (бензол) давала от альдегида 24до диола 22(окисление) и диальдегида 23 (альдольная конденсация.). Окисление дихромата натрия дало карбоновую кислоту 25, Диазометан, обработка дала метиловый эфир 26и боргидрид натрия аллиловый спирт 27. Хиральное разделение этого рацемического соединения с дигитонином дает хиральное 28 и при окислении Оппенауэра хиральное 29. гидрирование (катализатор Адамса ) дает спирт 30, хромовую кислоту, окисление дает кетон 31, боргидрид натрия, восстановление стереоселективно дает спирт 32, гидролиз с последующим ацилированием дает ацетат 33, тионилхлорид, обработка дает ацилхлорид 34и кетон 35.

. На последних стадиях реакция 35 с изогексилмагнийбромидом 36 дает диол 37, уксусную кислоту, обработка дает дегидратацию, а затем гидрирование дает ацетат 38 . Гидролиз этого сложного эфира дает холестанол 39. Путь от холестанола к холестерину был уже известен (см.: Синтез Робинсона).
