В органической химии, карбодиимид (систематическое название IUPAC: метандиимин ) представляет собой функциональную группу с формулой RN = C = NR. Они исключительно синтетические. Хорошо известным карбодиимидом является дициклогексилкарбодиимид, который используется в синтезе пептидов. Диалкилкарбодиимиды стабильны. Некоторые производные диарила имеют тенденцию превращаться в димеры и полимеры при стоянии при комнатной температуре, хотя это в основном происходит с карбодиимидами с низкой температурой плавления, которые являются жидкими при комнатной температуре. Твердые диарилкарбодиимиды более стабильны, но могут медленно подвергаться гидролизу в присутствии воды с течением времени.
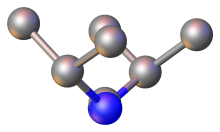 Вид сверху C (NC 3)2ядро C (NCHPh 2)2, как определено с помощью рентгеновской кристаллографии (цветовая схема: серый = C, синий = N)
Вид сверху C (NC 3)2ядро C (NCHPh 2)2, как определено с помощью рентгеновской кристаллографии (цветовая схема: серый = C, синий = N)  Вид сбоку на C (NC 3)2ядро C (NCHPh 2)2, как определено с помощью рентгеновской кристаллографии.
Вид сбоку на C (NC 3)2ядро C (NCHPh 2)2, как определено с помощью рентгеновской кристаллографии. С точки зрения связывания карбодиимиды изоэлектронны с углекислый газ. Карбодиимиды описывают три основные резонансные структуры:
Ядро N = C = N относительно линейно, а CN = C углы приближаются к 120 °. В случае C (NCHPh 2)2центральный угол N = C = N составляет 170 °, а углы CN = C находятся в пределах 1 ° от 126 °. Расстояния C = N короткие., около 120 часов, как это характерно для двойных связей. Карбодиимиды являются хиральными, обладают C 2 -симметрией и, следовательно, аксиальной хиральностью. Однако из-за низкого энергетического барьера молекулы, вращающейся и, тем самым, быстро превращаясь между ее изомерами, фактическое выделение одного оптического изомера карбодиимида чрезвычайно сложно. Это было продемонстрировано по крайней мере один раз в случае конформационно ограниченных циклических карбодиимидов; хотя есть и другие сообщения об одноручных аксиально хиральных карбодиимидах, их достоверность с тех пор была поставлена под сомнение на экспериментальных и расчетных основаниях.
Исходное соединение, метандиимин, (HN = C = NH), является таутомер из цианамида.
Классический путь получения карбодиимидов включает дегидросульфуризацию тиомочевин. Типичным реагентом для этого процесса является оксид ртути :
Эту реакцию часто можно проводить, как указано, даже если карбодиимиды реагируют с водой. В некоторых случаях к реакционной смеси добавляют дегидратирующий агент.
Дегидратация N, N'-диалкилмочевины дает карбодиимиды:
Пятиокись фосфора и п- толуолсульфонилхлорид использовались в качестве дегидратирующих агентов.
Изоцианаты могут быть преобразованы в карбодиимиды с потерей диоксид углерода:
Реакция катализируется оксидами фосфина. Эта реакция обратима.
По сравнению с другими гетероалленами карбодиимиды являются очень слабыми электрофилами и реагируют с нуклеофилами только в присутствии катализаторов, таких как кислоты. Таким образом могут быть получены гуанидины. В качестве слабых оснований карбодиимиды связываются с кислотами Льюиса с образованием аддуктов.
Карбодиимиды являются реагентами для окисления Моффатта, протокола преобразования спирта в карбонил (кетон или альдегид) с использованием диметилсульфоксида в качестве окислителя:
Обычно сульфоксид и диимид используются в избытке. В результате реакции образуется диметилсульфид и мочевина в качестве побочных продуктов.
В органическом синтезе соединения, содержащие карбодиимидную функциональную группу, используются для дегидратации В частности, их часто используют для преобразования карбоновых кислот в амиды или сложные эфиры. Добавки, такие как N-гидроксибензотриазол или N-гидроксисукцинимид часто добавляют для увеличения выхода и уменьшения побочных реакций.
Поликарбодиимиды также могут использоваться в качестве сшивающих агентов для водных смол. ins, такие как полиуретановые дисперсии или акриловые дисперсии. Здесь поликарбодиимид реагирует с карбоновыми кислотами, функциональные группы которых часто присутствуют в таких водных смолах, с образованием N-ацилмочевины. В результате между полимерными цепями образуются ковалентные связи, что делает их сшитыми.
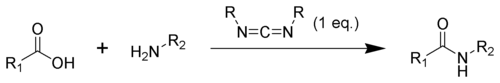
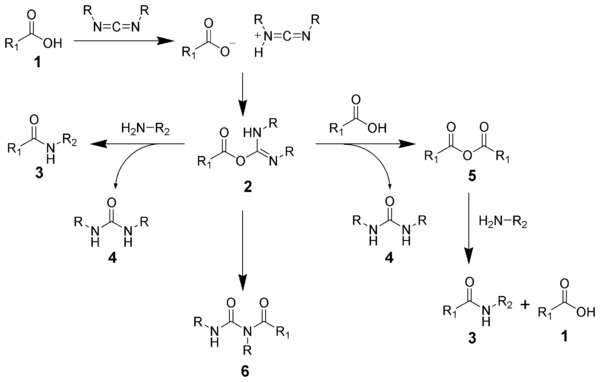
Образование амида с использованием карбодиимида является обычной реакцией, но сопряжено с риском несколько побочных реакций. Кислота 1 будет реагировать с карбодиимидом с образованием ключевого промежуточного соединения: O-ацилизомочевины 2, которую можно рассматривать как сложный эфир карбоновой кислоты с активированным выходом. группа. O-ацилизомочевина будет реагировать с аминами с образованием желаемого амида 3 и мочевины 4.
. Возможные реакции O-ацилизомочевины 2 дают как желаемые, так и нежелательные продукты. O-ацилизомочевина 2 может реагировать с дополнительной карбоновой кислотой 1 с образованием ангидрида кислоты 5, который может далее реагировать с образованием амида 3 . Основной нежелательный путь реакции включает перегруппировку O-ацилизомочевины 2 в стабильную N- ацилмочевину 6. Использование растворителей с низкими диэлектрическими постоянными, таких как дихлорметан или хлороформ, может минимизировать эту побочную реакцию.
 Структура дициклогексилкарбодиимида
Структура дициклогексилкарбодиимида DCC (аббревиатура от N, N'- дициклогексилкарбодиимид ) был одним из первых карбодиимидов, разработанных в качестве реагента. Он широко используется для образования амидов и сложных эфиров, особенно для синтеза твердофазного пептида. DCC приобрел популярность в основном благодаря своим реакциям сочетания амидов с высоким выходом и тому факту, что он довольно недорогой.
Однако DCC имеет некоторые серьезные недостатки, и его использования часто избегают по нескольким причинам:
 Структура N, N'-диизопропилкарбодиимида
Структура N, N'-диизопропилкарбодиимида В отличие от DCC, DIC (N, N ' -диизопропилкарбодиимид) представляет собой жидкость. Продукт гидролиза, N, N'-диизопропилмочевина, растворим в органических растворителях.
EDC - водорастворимый карбодиимидный реагент, используемый для широкого диапазона целей. Помимо использования, аналогичного использованию DCC и DIC, он также используется для различных биохимических целей в качестве сшивающего агента или химического зонда.
1-циклогексил- (2-морфолиноэтил) карбодиимидмето-п-толуолсульфонат представляет собой карбодиимид, разработанный для химического исследования структуры РНК в биохимии.