Функционализация углерод-водородной связи (C – H функционализация ) представляет собой тип реакции, в которой связь углерод-водород разрывается и заменяется связью углерод-X (где X обычно представляет собой углерод, кислород или азот). Термин обычно означает, что переходный металл участвует в процессе расщепления C-H. Реакции, классифицируемые этим термином, обычно включают углеводород, который первым реагирует с металлическим катализатором с образованием металлоорганического комплекса, в котором углеводород координирован с внутренней сферой. металла либо через промежуточное соединение «алкан или арен комплекс», либо в виде переходного состояния, приводящего к промежуточному соединению «M-C». Промежуточное соединение этой первой стадии (известное как активация C – H и иногда используется как синоним C-H функционализации) затем может подвергаться последующим реакциям с образованием функционализированного продукта. Важным для этого определения является требование, чтобы во время события C – H-расщепления, гидрокарбильные соединения оставались ассоциированными во внутренней сфере и под влиянием «M».
В качестве альтернативного определения другие авторы используют термин функционализация C – H для обозначения любого органического преобразования, в котором конечным результатом является преобразование относительно инертной связи C – H в C Связь –X (т.е. функциональная группа ), независимо от механизма (или с агностическим отношением к нему). В частности, это определение не требует координации переходного металла с углеводородом в механизме реакции. Это более широкое определение включает в себя более узкое определение, данное выше как подмножество. Однако это определение также включает катализируемую железом реакцию функционализации алканов, которая протекает через механизм отскока кислорода (например, ферменты цитохрома P450 и их синтетические аналоги), в которых связь металл-углерод не считается причастным. Точно так же реакционная способность на основе лигандов многих карбеновых соединений металлов с углеводородами также попадает в эту категорию, хотя некоторые случаи механистически неоднозначны. Некоторые авторы аналогичным образом определяют активацию C – H в широком смысле как стадию расщепления C – H любого механизма, который приводит к функционализации углеводородной группы (или любому наблюдаемому последствию разрыва связи C – H, например, обмену H / D). Третьи поддерживают исходное узкое определение термина активация C – H, в то же время используя функционализацию C – H в более широком смысле.
Механизмы активации CH можно разделить на три основные категории:
субстрат подвергается SEAr-типу механизм.
Первая реакция активации C – H часто приписывается O Это Димрот, который в 1902 году сообщил, что бензол реагирует с ацетатом ртути (II) (см.: ртутьорганическая ). Многие электрофильные металлические центры подвергаются этой реакции Фриделя-Крафтса. Джозеф Чатт наблюдал присоединение С-Н-связей нафталина комплексами Ru (0).
Преобладают активации С-Н с помощью хелатирования. Shunsuke Murahashi сообщил о катализируемой кобальтом хелатной -силовой CH-функционализации 2-фенилизоиндолин-1-она из (E) -N, 1-дифенилметанимина.
 Катализированный кобальтом CH активация
Катализированный кобальтом CH активация В 1969 г. А.Е. Шилов сообщил, что тетрахлороплатинат калия вызывал изотопный скремблинг между метаном и тяжелой водой. Было предложено, чтобы этот путь включал связывание метана с Pt (II). В 1972 году группа Шилова смогла произвести метанол и метилхлорид в аналогичной реакции, включающей стехиометрическое количество тетрахлороплатината калия, каталитический гексахлороплатинат калия, метан и вода. Из-за того, что Шилов работал и публиковался в Советском Союзе в эпоху холодной войны, его работы в значительной степени игнорировались западными учеными. Эта так называемая система Шилова сегодня является одной из немногих настоящих каталитических систем для функционализации алкана.
В некоторых случаях открытия в активации CH делались одновременно с перекрестной связью . В 1969 году Юзо Фудзивара сообщил о синтезе (E) -1,2-дифенилэтилена из бензола и стирола с Pd (OAc) 2 и Cu (OAc) 2, процедура очень похожа на перекрестную связь. По категории окислительного присоединения М. LH Green в 1970 году сообщил о фотохимическом внедрении вольфрама (в виде комплекса Cp 2WH2) в бензольную связь C – H и Джордж М. Уайтсайдс в 1979 году первым провел внутримолекулярную алифатическую C – H активацию
 Катализированную палладием и медью функционализацию CH Фудзивары
Катализированную палладием и медью функционализацию CH Фудзивары О следующем прорыве независимо друг от друга сообщили две исследовательские группы в 1982 году. Р. Г. Бергман сообщил о первой опосредованной переходным металлом межмолекулярной C – H-активации неактивированных и полностью насыщенных углеводородов путем окислительного присоединения. Используя фотохимический подход, фотолиз Cp * Ir (PMe 3)H2, где Cp * представляет собой пентаметилциклопентадиенил лиганд, привел к координационно ненасыщенным частицам Cp * Ir (PMe 3), который взаимодействовал посредством окислительного присоединения с циклогексаном и неопентаном с образованием соответствующих гидридоалкильных комплексов, Cp * Ir (PMe 3) HR, где R = циклогексил и неопентил, соответственно. WAG Graham обнаружил, что одни и те же углеводороды реагируют с Cp * Ir (CO) 2 при облучении с образованием родственных алкилгидридокомплексов Cp * Ir (CO) HR, где R = циклогексил и неопентил, соответственно. В последнем примере предполагается, что реакция протекает через окислительное присоединение алкана к 16-электронному промежуточному соединению иридия (I), Cp * Ir (CO), образованному при облучении Cp * Ir (CO) 2.
 C – H-активация Бергманом и др. (Слева) и Грэмом и др.
C – H-активация Бергманом и др. (Слева) и Грэмом и др.Селективная активация и функционализация алкановых связей C-H была описана с использованием комплекса вольфрама, снабженного пентаметилцикло пентадиенил, нитрозил, аллил и неопентильные лиганды, Cp * W (NO) (η-аллил) (CH 2 CMe 3).

В одном В примере, включающем эту систему, алкан пентан селективно превращается в галогенуглерод 1-иодпентан. Это превращение было достигнуто посредством термолиза Cp * W (NO) (η-аллил) (CH 2 CMe 3) в пентане при комнатной температуре, в результате чего при удалении неопентана с помощью процесса псевдопервого порядка с образованием необнаруживаемого электронно и стерически ненасыщенного 16-электронного промежуточного соединения, которое координируется η -бутадиеном лигандом. Последующая межмолекулярная активация молекулы пентанового растворителя затем дает 18-электронный комплекс, обладающий н-пентильным лигандом. На отдельной стадии реакция с йодом при -60 ° C высвобождает 1-иодпентан из комплекса.
Направленная, хелатная или «управляемая» активация C-H включает управляющие группы, которые влияют на регио- и стереохимию. Это наиболее полезный способ активации C-H в органическом синтезе. N, N-диметилбензиламин легко подвергается циклометаллированию многими переходными металлами: полупрактические реализации включают слабо координирующие направляющие группы, как проиллюстрировано реакцией Мурая.
 Реакция Мурая. X = направляющая группа.
Реакция Мурая. X = направляющая группа.Механизм катализируемых Pd реакций активации C-H 2-фенилпиридина включает промежуточное соединение металлацикла. Промежуточный продукт окисляется с образованием частиц Pd с последующим восстановительным элиминированием с образованием связи CO и высвобождением продукта.
 Механизм катализируемой Pd активации CH.
Механизм катализируемой Pd активации CH. Преобразование связей CH в CB связи посредством борилирования были тщательно исследованы из-за их полезности в синтезе (т.е. для реакций перекрестного связывания). Дж. F. Hartwig сообщил о высокорегиоселективном борилировании арена и алкана, катализируемом родиевым комплексом. В случае алканов наблюдалась исключительно терминальная функционализация.

Позже было обнаружено, что рутениевые катализаторы обладают более высокой активностью и совместимостью функциональных групп.
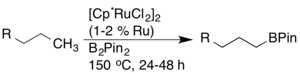
Были также разработаны другие катализаторы борилирования, включая катализаторы на основе иридия, которые успешно активируют CH-связи с высокой совместимостью.
Для получения дополнительной информации см. borylation.
Встречающийся в природе метан, несмотря на то, что он не используется в качестве химического сырья его обилие и невысокая стоимость. Современные технологии широко используют метан путем парового риформинга для производства синтез-газа, смеси монооксида углерода и водорода. Этот синтез-газ затем используется в реакциях Фишера-Тропша для получения продуктов с более длинной углеродной цепью или метанола, одного из наиболее важных промышленных химических сырьевых материалов. Интересный метод преобразования этих углеводородов включает активацию C-H. Periana, например, сообщил, что комплексы, содержащие поздние переходные металлы, такие как Pt, Pd, Au и Hg, реагируют с метаном (CH 4) в H 2SO4с получением метилбисульфата. Однако этот процесс не был реализован в коммерческих целях.
.
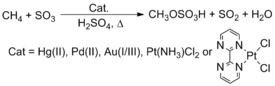
 Метилфенилдиазоацетат является прекурсором для асимметричной активации CH виадонор-акцепторный карбен с использованием хирального диродиевого катализатора.
Метилфенилдиазоацетат является прекурсором для асимметричной активации CH виадонор-акцепторный карбен с использованием хирального диродиевого катализатора. Полный синтез литоспермовой кислоты использует управляемую позднюю стадию функционализации CH до высоко функционализированной система. Управляющая группа, хиральный нерацемический имин, способна осуществлять внутримолекулярное алкилирование, которое обеспечивает катализируемое родием превращение имина в дигидробензофуран.

Полный синтез калотриксина A и B включает: внутримолекулярная реакция кросс-сочетания, катализируемая Pd, через активацию CH, пример управляемой активации CH. Перекрестное связывание происходит между арильными связями C-I и C-H с образованием связи C-C. В синтезе аналога мескалина используется катализируемое родием энантиоселективное аннелирование арилимина посредством активации CH.