| Грудной имплант | |
|---|---|
 Воспроизвести Видео, на который врачует грудную клетку для имплантатов. Воспроизвести Видео, на который врачует грудную клетку для имплантатов. | |
| Специальность | Пластическая хирургия |
| [редактировать в Викиданных ] | |
A грудной имплант - это протез, использование для изменения размера, форма и контур груди человека. В реконструктивной пластической хирургии грудные имплантаты могут быть установлены для восстановления естественного вида груди после мастэктомии или для исправления врожденных дефектов и деформаций грудной стенки. Они также используются в косметических целях для увеличения внешнего вида посредством операции по увеличению груди.
Осложнения имплантатов могут быть включены боль в груди, изменения кожи, инфекция, разрыв и скопление жидкости вокруг груди..
Существуют основные четыре типа грудных имплантатов, определяемых их наполнителем: физиологический раствор, силиконовый гель, структурированный и композитный наполнитель. Имплантат с солевым раствором оболочку из эластомера силикона, заполненную стерильным физиологическим раствором во время операции; силиконовый имплант имеет силиконовую оболочку из эластомера, начальную заполненную вязким силиконовым гелем; в структурированных имплантатах используются вложенные силиконовые оболочки из эластомера и два просвета, заполненных жидким раствором; а имплантаты альтернативной композиции разные наполнители, такие как соевое масло или полипропиленовая нить. Композитные имплантаты, как правило, больше не рекомендуются для использования, фактически, их использование в США и Европе из-за связанных с этим рисков для здоровья и осложнений.
В хирургической практике для реконструкции груди расширитель ткани устройство представляет собой временный протез груди, средство для формирования и установки кармана имплантата для будущего имплантата груди. Для коррекции дефектов и деформаций мужской груди грудной имплант представляет собой протез груди, реконструкцию и эстетического ремонта грудной стенки мужчины (см.: гинекомастия и мастопексия ).
A маммопластику. Процедура установки имплантатов груди преследует три цели:
операционная (ИЛИ) время после операции - мастэктомия реконструкция груди и операция по увеличению груди определяется используемой процедурой, типом разреза грудным имплантатом (типом и материалами) и местом расположения грудной клетки.
Недавние показали, что маммограммы не должны проводиться с большей степенью исследования, чем при обычных процедурах, у пациентов, перенесших операции на груди, включая имплантат грудей и, увеличение, мастопексию и уменьшение груди.
Пациенткой увеличение груди обычно молодая женщина, личностный профиль указывает на психологический стресс из-за ее внешнего вида и своего телесного образ себя, а также на то, что она пережила критику. (поддразнивая) о эстетике ее личности. Сообщается, что женщина, перенесшая операцию по увеличению груди, также прошла психотерапию »(2003) и« Дисморфическое расстройство тела и косметическая хирургия »(2006) сообщается, что женщина, перенесшая операцию по увеличению груди., пострадала мало. чувство собственного достоинства, частые случаи психологической депрессии, попытки самоубийства и страдание телесной дисморфией, типом психического заболевания.
Послеоперационные опросы пациентов о психическом здоровье и качестве жизни показали улучшение физического здоровья, внешнего вида, социальной жизни, уверенности в себе, самооценки и удовлетворительного сексуального функционирования. Кроме того, сообщили о долгосрочном удовлетворении результатов имплантации груди; Некоторые, несмотря на осложнения, потребовавших хирургического вмешательства, корректирующего или эстетического. Аналогичным образом, в Дании у 8 процентов пациентов с повреждениями до операции была история психиатрической госпитализации.
В 2008 году лонгитюдное исследование Избыточная смертность от самоубийств и другие внешние причины смерти среди женщин с косметическими имплантатами груди (2007), сообщили, что женщины, которые пытались году грудные имплантаты, почти в 3 раза чаще совершали самоубийство, чем женщины, которые не искали грудные имплантаты. По сравнению со стандартным уровнем самоубийств среди женщин из общей массы, уровень самоубийств среди женщин с увеличенной грудью оставался до 10 лет после имплантации, однако он увеличился в 4,5 раза за 11 лет, и поэтому оставался до 19-летней отметки, когда через 20 лет после имплантации она увеличилась в 6 раз. Кроме того, помимо риска самоубийства, женщины с грудными имплантатами также сталкивались с утренним риском смерти от алкоголизма и злоупотребления рецептурными и рекреационными наркотиками. Исследования показывают, что операция по увеличению увеличения не увеличивает уровень смертности; и что, в первую очередь, именно склонная к психопатологии женщина с большей вероятностью перенесет значение увеличения груди.
Исследование «Эффект увеличения груди» Маммопластика на самооценку и сексуальность: количественный анализ (2007) сообщает, что женщины приписывают свое улучшенное самооценку, самооценку и повышенное удовлетворительное сексуальное функционирование тем, что подверглись увеличению груди; в возрасте 21–57 лет среднее повышение самооценки после операции СМЕИ от 20,7 до 24,9 балла по 30-балльной шкале самооценки Розенберга, данные которой подтверждают рост на 78,6% либидо женщины по отношению к ее дооперационному уровню либидо. Поэтому, прежде чем соглашаться на операцию, пластический хирург оценивает и рассматривает психическое здоровье, чтобы определить женщины грудные имплантаты положительно повлиять на ее самооценку и сексуальные функции.
пластическая хирургия установка имплантатов груди для реконструкции груди или для эстетических целей представляет те же риски для здоровья, что и хирургия, например, побочная реакция на анестезию, гематома (послеоперационное кровотечение), поздняя гематома (послеоперационное кровотечение через 6 месяцев и более), серома (скопление жидкости), распад в месте разреза (раневая инфекция). Осложнения, характерные для увеличения груди, включают в себя грудь, изменение чувствительности, нарушение функции грудного вскармливания, видимые морщины, асимметрию, истончение ткани груди и симмастию, «буханку хлеба» бюста, которая прерывает естественное плоскость между грудями. Специфические методы лечения осложнений, связанных с постоянными грудными имплантатами - контрактуры капсулы и разрыва капсулы - включают периодический МРТ мониторинг и физикальные обследования. Кроме того, осложнения и повторные операции, связанные с операцией по имплантации, а также с >рителями тканей (подставками для имплантатов во время операции) могут вызвать неблагоприятное рубцевание примерно в 6 случаях. –7% пациентов. По статистике, 20% женщин была проведена косметическая имплантация, а 50% женщин перенесли реконструктивную имплантацию груди, потребовали эксплантации через 10 лет.
В начале 1990-х годов министерства здравоохранения перечисленных стран провели соответствующие исследованияно-следственные связи между силиконовыми гелевыми имплантатами груди и системными и аутоиммунными заболеваниями. Общий вывод состоит в том, что нет никаких доказательств, устанавливает причинную связь между имплантацией силиконовых грудных имплантатов и любым типом заболеваний. Датское исследование «Долгосрочное состояние здоровья этих женщин с силиконовыми имплантатами груди» (2004 г.) показало, что женщины, в среднем были имплантаты груди в течение 19 лет, не чаще сообщали о чрезмерном количестве симптомов ревматической болезни. чем женщины контрольная группы. В последующем исследовании смертности среди пациентов с увеличивающейся маммопластикой: обновление (2006) стандартизованного коэффициента смертности и повышенного риска смерти от рака легкого смерти от пациентов с имплантатами груди, чем пациенты для других видов пластических операций; различия на уровне смертности были связаны с курением табака. В исследовании «Смертность среди канадских женщин с косметическими имплантатами груди» (2006 г.) около 25 000 женщин с грудными имплантатами сообщалось о том, что уровень заболеваемости раком груди у них на 43 процента ниже, чем население в целом, и риск рака ниже среднего..
| Год | Страна | Группа системной проверки | Выводы |
|---|---|---|---|
| 1991–93 | Соединенное Королевство | Консультативная группа (IEAG) | Не было доказано повышенного риска заболеваний соединительной ткани у пациентов, перенесших имплантацию грудного имплантата силикон-гелевого сплава, а также для изменений практики или политики в отношении грудных имплантатов в Великобритании. |
| 1996 | США | США Институт медицины (IOM) | Не было «недостаточно доказательств связи имплантатов груди, заполненных силиконовым гелем или физиологическим раствором, определенным заболеванием соединительной ткани. ». |
| 1996 | Франция | Agence Nationale pour le Developpement de l'Evaluation Medicale (ANDEM) [Национальное агентство по медицинскому развитию и оценке] | Французский оригинал: "Nous n'avons pas observé de connectivité ni d'autre patologie auto -immuneceptible d'être direct или косвенный индуктивен при наличии имплантата в маммере и в частности в геле силикона.... " русский перевод:" Мы не наблюдали заболеваний соединительной ". ткани, которые прямо или косвенно связаны с наличием грудного имплантата, в частности силиконового геля.... " |
| 1997 | Австралия | Терапевтические устройства Комитет по оценке (TDEC) | «Настоящая литература предполагает, что нет никакой связи между грудными имплантатами и синдромами, подобными заболеваниями соединительной ткани (атипичные заболевания соединительной ткани)». |
| 1998 | Германия | >Медицинский институт медицинских изделий | Сообщил, что "силиконовые грудные имплантаты не вызывают аутоиммунных заболеваний или ревматических заболеваний и не оказывают неблагоприятного воздействия на беременность". Никаких методов лечения заболеваний, вызывающих аллергию на силикон, отравления силиконом, атипичных заболеваний или нового силиконового заболевания ». |
| 2000 | США | Рассмотрение по решению федерального суда | «Нет доказательств связи между... имплантатами груди, наполненными силиконовым гелем, и какими-либо отдельными CTD, всеми определенными CTD вместе взятыми, или другими аутоиммунными или ревматическими состояниями». |
| 2000 | Европейский Союз | Европейский комитет по обеспечению качества и медицинским приборам в пластической хирургии (EQUAM) | «Дополнительные медицинские е исследования не применимы никакой связи между грудными имплантатами, наполненными силиконовым гелем, и традиционными аутоиммунными заболеваниями или заболеваниями соединительной ткани, рак или любые другие злокачественные заболевания.... EQUAM по-прежнему считает, что нет научных доказательств существования аллергии на силикон, силиконовой интоксикации, атипичного заболевания или «нового силиконового заболевания» ». |
| 2001 | Соединенное Королевство | UK Independent Review Group (UK-IRG) | «Нет доказательств связи аномальным иммунным ответом или типичными или атипичными заболеваниями или синдромами соединительной ткани. ». |
| 2001 | США | Назначенная судом оценка Национальной научной комиссии | Комиссия оценила установленные и недифференцированные заболевания соединительной ткани (CTD) и пришла к выводу, что между имплантатами и этого CTD нет причинно-следственных связей. |
| 2003 | Испания | Оценка вариантов науки и технологий (STOA) | В отчете STOA Комитету по петициям Европейского парламента сообщается, что текущие научные данные не демонстрируют убедительных причин- следственных доказательств, связывающих SBI [силикон грудные имплантаты] к тяжелым заболеваниям, например рак груди, соединительная ткань |
| 2009 | Европейский Союз | Панель Международного комитета по обеспечению качества, медицинские технологии и устройства в пластической хирургии (IQUAM) | Конференция о консенсусе Transatlantic Innovations (апрель 2009 г.) указала, что дополнительные медицинские исследования не применяют связи между грудными имплантатами, наполненными силиконовым гелем, и карциномой, или каким-либо метаболическим, иммунным или аллергическим расстройством. |
представляет собой медицинское изделие класса III с ограниченным сроком службы, факторы скорости разрушения являются его возрастом и конструкцией; Тем не менее, устройство грудного имплантата может попробовать свою механическую целостность в теле женщины. Когда грудной имплантат физиологическим средством разрывается, протекает и опорожняется, он быстро сдувается, таким образом, может быть легко эксплантирован (удаленным хирургическим путем). В последующем отчете «Натрелле солевые имплантаты груди: проспективное 10-летнее исследование» (2009 г.) указано, что уровень разрыва-дефляции составляет 3–5% через 3 года после имплантации и 7–10%. показатели через 10 лет после имплантации.
 Отказ имплантата груди: части имплантированного хирургического имплантата - это красная фиброзная капсула (слева), разрыв силиконового имплантата (в центре) и прозрачный гель-наполнитель, протекает вместе с капсулой (справа).
Отказ имплантата груди: части имплантированного хирургического имплантата - это красная фиброзная капсула (слева), разрыв силиконового имплантата (в центре) и прозрачный гель-наполнитель, протекает вместе с капсулой (справа). Когда силиконовый грудной имплантат разрывается, он обычно не сдувается, но этот гель-наполнитель вытекает из него, который может мигрировать в карман имплантата; следовательно, внутрикапсульный разрыв (утечка внутри капсулы) может стать экстракапсулярным разрывом (утечка вне капсулы), и каждый случай разрешается путем эксплантации. Хотя просочившийся силиконовый гель-наполнитель может мигрировать из тканей грудной клетки в другие тела, большинство клинических заболеваний ограничиваются областями груди и подмышек, обычно проявляется в виде гранулем (воспалительных узлов) и подмышечной лимфаденопатии (увеличение лимфатических узлов в области подмышек).
Предполагаемые механизмы разрыва грудной железы имплантата представляют собой:
Разрыв силиконового имплантата можно оценить с помощью магнитно-резонансной томографии; длительный срок данные МРТ для однопросветных грудных имплантатов, европейская литература о силиконовых гелевых имплантатах второго поколения (дизайн 1970-х годов), сообщила о числе бесшумных разрывов устройств 8–15% через 10 лет после имплантации (15–30% пациентов).
Исследование «Безопасность и эффективность имплантатов Mentor's MemoryGel через 6 лет» (2009 г.), которое являлось отраслевым исследованием Основные клинические испытания Управления по конт ролю за продуктами и лекарствами США для пациентов с первичной операцией по увеличению груди сообщили о низкой частоте разрывов устройств, составляющей 1,1%, через 6 лет после имплантации. Первая серия МРТ оценок силиконовых грудных имплантатов с густым наполнителем-гелем показала, что частота разрывов устройства составляет 1 процент или меньше при среднем 6-летнем возрасте устройства. Статистически ручное обследование (пальпация) женщины не позволяет точно определить, разорвался ли грудной имплантат. В исследовании «Диагностика разрыва силиконового грудного имплантата: клинические результаты по сравнению с результатами магнитно-резонансной томографии» (2005 г.) сообщается, что у бессимптомных пациентов только 30% разорванных грудных имплантатов точно пальпируются и обнаруживаются опытным пластическим хирургом., тогда как МРТ точно выявила 86 процентов разрывов грудных имплантатов. Поэтому FDA США рекомендовало плановые МРТ-обследования в качестве скрининговых обследований на отсутствие разрыва, начиная с 3-летней отметки после имплантации, а затем каждые два года. Тем не менее, за пределами США медицинские учреждения других стран не одобрили рутинный скрининг МРТ и вместо этого предложили зарезервировать такое радиологическое обследование для двух целей: (i) для женщин с подозрение на разрыв грудного имплантата; и (ii) для подтверждения маммографических и ультразвуковых исследований, которые указывают на наличие разрыва грудного имплантата.
Кроме того, влияние систематической ошибки дизайна исследования на Диагностическая точность магнитно-резонансной томографии для обнаружения разрыва силиконового имплантата груди: метаанализ (2011) сообщил, что скрининговые МРТ молочных желез у бессимптомных женщин могут переоценить частоту разрыва грудного имплантата. При этом Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США подчеркнуло, что «грудные имплантаты не являются устройствами на всю жизнь. Чем дольше женщина пользуется имплантатами груди, заполненными силиконовым гелем, тем выше вероятность осложнений ».
иммунный ответ человеческого организма на хирургическое вмешательство установленный инородный объект - грудной имплант, кардиостимулятор кардиостимулятор, ортопедический протез - для инкапсуляции рубцовой ткани капсул из плотно сплетенных коллаген волокна, чтобы поддерживать целостность тела, изолируя инородный объект, и таким образом переносить его присутствие. Капсульная контрактура - которую следует отличать от нормальной капсульной ткани - возникает, когда капсула из коллагеновых волокон утолщается и сжимает грудной имплант; это болезненное осложнение, которое может исказить либо грудной имплант, либо грудь, либо и то, и другое.
 Несостоятельность имплантата груди: капсульная контрактура - это медицинское осложнение, в данном случае сокращение субгландулярного силиконового имплантата в правой груди по шкале Бейкера IV степени.
Несостоятельность имплантата груди: капсульная контрактура - это медицинское осложнение, в данном случае сокращение субгландулярного силиконового имплантата в правой груди по шкале Бейкера IV степени. Причина капсулярной контрактуры неизвестна, но наиболее распространенная Факторы заболеваемости, включая бактериальное загрязнение, разрыв корпуса устройства, утечку наполнителя и гематому. Хирургические процедуры имплантации, которые снизили частоту капсулярной контрактуры, включая подмышечную имплантацию, использование грудных имплантатов с текстурированной поверхностью (с полиуретановым покрытием); ограниченное предоперационное обращение с имплантатами, ограниченный контакт с кожей грудной клетки кармана имплантата перед установкой грудного имплантата и ирригация области реципиента тройными растворами антибиотиков.
Коррекция капсульной контрактуры может потребоваться открытая капсулотомия (хирургическое высвобождение) капсулы из коллагеновых волокон или удаление и возможная замена грудного имплантата. Кроме того, при лечении капсулярной контрактуры закрытая капсулотомия (разрыв с помощью внешних манипуляций) когда-то было обычным приемом для лечения твердой капсул, но сейчас это не рекомендуется, это может привести к разрыву грудного имплантата. Нехирургические методы лечения капсул из коллагеновых волокон включают массаж, внешнюю ультразвуковую терапию, ингибиторы лейкотриенового пути, такие как зафирлукаст (Accolate) или монтелукаст (Singulair) и импульсным электромагнитным полем (PEMFT).
Когда пациент не удовлетворен результатом увеличивающей маммопластики; или при возникновении технических или медицинских осложнений; или из-за ограниченного срока службы грудных имплантатов вполне вероятно, что ей может потребоваться замена грудных имплантатов. Общие показания к ревизионной хирургии включают серьезные и незначительные медицинские осложнения, капсульную контрактуру, разрыв оболочки и дефляцию устройства. Частота ревизий была выше у пациентов с реконструкцией груди из-за постмастэктомических изменений мягких тканей и кожной оболочки груди, а также анатомических границ груди, особенно у женщин, которые получили адъювантную внешнюю лучевую терапию. Более того, реконструкции груди, пациентом с раком груди обычно проводят ревизионную операцию комплекса соск-ареола (NAC) и процедуры симметрии на противоположной груди, чтобы создать бюст естественного внешнего вида, размера, и Чувствовать. Тщательное соответствие типа и размера грудных имплантатов характеристики мягких тканей пациента снижает частоту повторных операций. Соответствующее сопоставление тканей, выбор имплантата и надлежащая техника имплантации, частота повторных операций составляет 3 процента через 7 лет, по сравнению с 20 процентами повторных операций через 3 года, как сообщает по санитарному надзору за качеством пищевых продуктов и медикаментов США.
 Рентген грудной клетки, показывающие грудные имплантаты
Рентген грудной клетки, показывающие грудные имплантаты С начала 1990-х годов в независимых комплексных обзорах были изучены исследования, касающиеся связи между силиконовыми гелевыми имплантатами груди. и заявления о системных заболеваниях. Консенсус этих обзоров (изложенных ниже под заголовком «Безопасность грудных имплантатов») заключается в том, что не было доказательств причинно-следственной связи между имплантацией солевых или силиконовых грудных имплантатов и системным заболеванием. FDA США согласилось и с тех пор подтвердил, что «масса эпидемиологических данных, опубликованных в литературе, не поддерживает связь между фибромиалгией и грудными имплантатами». В комплексном системном обзоре Lipworth (2011) делается вывод, что «любые оставшиеся утверждения относительно связи между косметическими имплантатами груди и CTD не подтверждаются научной литературой».
Платина представляет собой катализатор, используемый при изготовлении силиконовых полимерных оболочек имплантатов и других силиконовых устройств, используемых в медицине. В литературе указывается, что небольшое количество платины вымывается (вытекает) из этих имплантатов и присутствует в окружающих тканях. FDA проанализировало использование в медицинской литературе исследования платины и грудных имплантатов в 2002 году и пришло к выводу, что данных, свидетельствующих о токсичности платины у пациентов с имплантатами, мало. FDA повторно посетило это исследование и дополнительную литературу несколько лет спустя, подтвердило предыдущие выводы о том, что платиновые катализаторы, использованные в импатах, вероятно, не ионизируются и, следовательно, не представляют риска для женщин.
FDA установило, что грудные имплантаты связаны с редкой формой рака, называемой анапластической крупноклеточной лимфомой, которая, как считается, связана с хроническим бактериальным воспалением. Подобные явления ALCL наблюдались и с другими типами медицинских имплантатов, включая порты для сосудистого доступа, ортопедические имплантаты бедра и имплантаты челюсти (ВНЧС). В 2015 году пластические хирурги опубликовали статью с обзором 37 статей в литературе о 79 пациентах и собрали еще 94 незарегистрированных случая, в результате чего у 173 женщин с имплантатами груди развился ALCL груди. Они пришли к выводу, что «связанная с грудным имплантатом ALCL - это новое проявление лимфомы, специфичной для сайта и материала, которая возникает в определенном месте рубца, имеет широкий спектр разнообразных характеристик и предполагает многофакторную причину». Они заявили, что «не было предпочтения ни физиологическому раствору, ни силиконовому наполнителю, ни косметическим или реконструктивным показаниям». Получил по крайней мере одно устройство с текстурированной поверхностью. В 2016 году Всемирная организация здравоохранения (ВОЗ) официально признал BIA-ALCL.
По состоянию на 1 февраля 2017 г. FDA получило в общей сложности 35 отчетов о медицинских устройствах с ALCL, связанными с грудными имплантатами (BIALCL), включая 9 смертельных случаев. Причинная связь между грудными имплантатами и ALCL была окончательно установлена в декабре 2013 года, когда исследователи из онкологического центра MD Anderson Cancer Center опубликовали исследование 60 женщин с грудными имплантатами, которым был поставлен диагноз ALCL в груди. Считалось, что ALCL диагностируется только у 1 женщины из полумиллиона, 60 женщин было намного большим числом, чем можно было бы ожидать. Исследователи отметили, что BIA-ALCL может быть фатальным. Если у женщин с имплантатами наблюдается отсроченный отек или сбор жидкости, необходимо провести цитологические исследования и тест на маркер CD30. Американское общество пластической хирургии (ASPS) заявляет: «CD30 - это основной диагностический тест, который необходимо проводить на серомной жидкости, поскольку это обычная патология, или окрашивание HE часто может не поставить диагноз». Диагностика и лечение ALCL, связанного с грудным имплантатом, теперь следует стандартизированным стандартам, установленным Национальной комплексной онкологической сетью.
Текущий пожизненный риск BIA-ALCL в США неизвестен, но оценки колеблются от одного из 70 000 до одной из 500 000 женщин с грудными имплантатами, по данным Онкологического центра им. доктора медицины Андерсона. Некоторые географические районы демонстрируют переменные риски. Например, в обновленном сообщении Управления терапевтических товаров Австралии и Новой Зеландии за декабрь 2016 г. Сообщалось о риске от 1: 1000 до 1:10 000 для текстурированных имплантатов ". На сегодняшний день (2017 г.) не было зарегистрировано ни одного случая BIAL, в котором пациенту был имплантирован только грудная имплантат с гладкой оболочкой или расширитель текстурированной ткани, который Небольшое количество случаев, зарегистрированных в азиатских популяциях, увеличивает вероятность того, что может существовать целый ряд генетических предрасположенностей к этому явлению; в качестве альтернативы, он может отражать разные в способах определения и регистрации случаев.
ASPS и Фонд пластической хирургии (PSF) в партнерстве с FDA изучили это состояние и таким образом, создали Реестр пациентов и результаты для грудных имплантатов и этиология и эпидемиология анапластической крупноклеточной лимфомы (ПРОФИЛЬ). FDA рекомендует всем врачам сообщать о случаях заболевания в ПРОФИЛЬ, чтобы лучше понять роль восточные имплантаты в ALCL и лечени е этого заболевания.
Установка грудного имплантата выполняется с пятью (5) типами хирургических операций:
 Субгландулярный имплант
Субгландулярный имплант  Субпекторальный имплант
Субпекторальный имплант  Субмышечный имплант
Субмышечный имплант Пять хирургических подходов к установке грудного имплантата в карман имплантата часто описываются в атомное отношение к большой грудной мышце.
хирургические рубцы после увеличения груди маммопластики появляются примерно через 6 недель после операции и исчезают в течение нескольких месяцев. В зависимости от повседневных физических нагрузок, требуемых женщин, пациентка, увеличивающая грудь, обычно возвращается к нормальной жизни через 1 неделю после операции. Более того, женщины, чьи грудные имплантаты размещены под грудными мышцами (подмышечная установка), обычно имеют более длительное, немного более болезненное выздоровление из-за заживления на грудных мышцах. Обычно она не занимается спортом и не занимается интенсивными физическими нагрузками в течение примерно 6 недель. Во время первоначального послеоперационного восстановления женщине рекомендуется регулярно упражнять (сгибать и двигать) руку, чтобы облегчить боль и дискомфорт; при необходимости, обезболивающие катетеры для постоянного приема лекарств могут облегчить боль. Более того, значительно улучшилось выздоровление пациента благодаря усовершенствованным методам имплантации грудных устройств (подмышечным, субгландулярным), которые позволяют 95 процентам женщин вернуться к нормальной жизни в 24 года. -часы после процедур, без перевязок, дренажа жидкости, обезболивающих, катетеров, поддерживающих бюстгальтеров или наркотических обезболивающих.
 физиологического раствора -заполнены раствор модели грудных имплантатов.
физиологического раствора -заполнены раствор модели грудных имплантатов. Сегодня существует три типа грудных имплантатов, обычно используются для маммопластики, реконструкция груди и увеличение груди процедуры:
Четвертый тип имплантата композитные (или альтернативно-композитные) имплантаты в основном прекращены. Эти содержащие наполнители, такие как соевое масло и полипропиленовая нить. К другим материалам, снятым производством, относится бычий хрящ, териленовая вата, измельченный каучук, силиконовый каучук и тефлон-силиконовые протезы.
Солевые имплантаты груди - заполненные физиологическим растворенным (соленая вода с биологической концентрацией 0,90% мас. / Об NaCl, примерно 300 мОсм / л.) - впервые произведена компанией Laboratoires Arion, во Франции, представлена для использования в качестве протезного медицинского устройства в 1964 году. Современные модели солевых имплантатов груди производятся с более толстыми вулканизированными (RTV) оболочками, изготовленными при комнатной температуре. из силиконового эластомера. В предварительное введение физиологических имплантатов груди (2006) введено предварительное физиологическое имплантатов груди (2006). Тем не менее, в 1990-е гг. Грудной имплантат был протезом наиболее распространенным, используемым для операций по увеличению груди, из-за ограничения FDA США на имплантацию имплантатов груди с силиконом вне условий. исследования. Импаты груди из солевого агентства занимаются большой популярностью в остальном мире.
Технической целью технологии имплантации солевого метода была физически менее инвазивная хирургическая техника для установки пустого устройства грудного имплантата через меньший хирургический разрез. В хирургической практике, после установки пустых грудных имплантатов в карманные имплантаты, пластический хирург заполняет каждое устройство физиологическим препаратом, поскольку требуемые вставные разрезы и маленькие, полученный в результате разрез - шрамы будут меньше и короче короче, чем хирургические шрамы до длинных разрезов, необходимых для установки обычных заполненных силиконовых гелевых имплантатов.
По результатам, достигнутым с помощью силиконового гелевого грудного имплантата, солевой имплантат может дать приемлемые результаты: увеличенный размер груди, более гладкий контур полушария и реалистичная текстура; тем не менее существует вероятность возникновения косметических проблем, таких как волнистость и морщинистость кожи оболочки груди, ускоренное растяжение нижнего полюса груди и технические проблемы, такие как присутствие имплантата, заметного для глаза и на ощупь.. Возникновение таких косметических проблем более вероятно в случае женщины с очень небольшим тканью груди и в случае женщины, которой требуется реконструкция груди после мастэктомии ; Таким образом, силиконовый гелевый имплантат является технически более совершенным протезом для увеличения груди и для реконструкции груди. В случае женщины с большой грудной тканью, рекомендуется хирургическое вмешательство под мышечную имплантацию, солевые грудные имплантаты дают эстетический результат, аналогичный, который дает силиконовые грудные имплантаты, хотя и с большей пальпируемостью имплантата.
Как медицинское устройство технология, существует пять поколений силиконовых грудных имплантатов, каждый из которых определяет общими методами изготовления моделей.
Современный протез груди был изобретен в 1961 году американскими пластическими хирургами Томасом Кронином и Фрэнком Героу и изготовлен корпорацией Dow Corning ; со временем первая увеличивающая маммопластика была проведена в 1962 году.
Имплант Cronin - Gerow, модель протеза 1963 года, представляющий собой силиконовый резиновый мешок-конверт в форме капли. который был заполнен вязким силиконовым гелем. Чтобы уменьшить вращение установленного грудного имплантата на грудной стенке, протез модели 1963 года был прикреплен к карману имплантата с помощью фиксатора-заплатки из материала дакрон (полиэтилентерефталат ), который прикреплялся к задней части оболочки грудного имплантата.
В 1970-х производители представили второе поколение протезовных имплантатов, которые были реализованы функциональные и эстетические усовершенствования технологий:
В 1980- х годах модели третьего и четвертого поколений устройств для грудных имплантатов были последовательным прогрессом в технологиях производства, например, оболочки с покрытием из эластомера, которые уменьшали просачивание геля (утечку наполнителя), и более толстые (повышенная когезии) гель- наполнитель. Социологически производители протезов груди разработали и изготовили анатомические модели (натуральная грудь) и модели формы (круглые, конические), которые соответствуют типу груди и телосложения женщины. Конические модели грудных имплантатов имеют однородную текстурированную поверхность, что снижает вращение протеза внутри кармана имплантата; круглые модели грудных имплантатов доступны с гладкой и текстурированной поверхностью.
С середины 1990-х годов пятое поколение силиконовых грудных имплантатов изготавливается из высокопрочного, высококогезивного силиконового геля, который в основном устраняет утечки наполнителя («Кровотечение из силиконового геля») силиконового наполнителя из кармана имплантата в другое место на теле женщины. Эти имплантаты обычно называют «имплантатами груди мармеладного медведя» из-за их твердой, эластичной консистенции, которая похожа на мармеладные конфеты. В исследованиях «Опыт применения анатомических мягких когезионных силиконовых гелевых протезов в косметической и реконструктивной хирургии грудных имплантатов» (2004 г.) и «Когезивных силиконовых гелевых имплантатов в эстетической и реконструктивной хирургии груди» (2005 г.) сообщается о низкой основе возникновения капсулярной контрактуры и разрыва прибор-оболочка; и более высокие показатели медицинской безопасности и технической эффективности, чем у устройств грудных имплантатов раннего поколения.
Структурированные имплантаты были одобрены FDA и министерством здравоохранения Канады в 2014 году как третьи форма грудного имплантата. Структурированные имплантаты технологий имплантации как солевого раствора, так и силиконового геля. Наполнитель представляет собой только физиологический раствор в случае разрыва и имеет естественное ощущение, как имплантаты из силиконового геля. В имплантате используется внутренняя структура, которая состоит из ряда вложенных оболочек, поддерживающих верхний полюс, причем два просвета заполнены только физиологическим раствором. Имплант вставляется пустым, а затем один раз заполняется на место, что требует меньшего разреза, чем заполненные имплантаты. Если один из просветов структурированного имплантата разрывается, он протекает и опорожняется. Другой просвет остается нетронутым, а имплантат сдувается лишь частично, что упрощает извлечение и замену эксплантата.
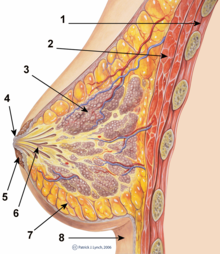 Схема поперечного сечения молочной железы.
Схема поперечного сечения молочной железы. Наличие грудных имплантатов в настоящее время не является противопоказанием к грудному вскармливанию и не является подтверждением того, что эта практика может вызвать проблемы со здоровьем у грудного ребенка, признана USFDA.
Женщины с грудными имплантатами имеют функциональные трудности при кормлении грудью; Маммопластика с периареолярными разрезами особенно часто вызывает затруднения при кормлении грудью. Хирургическое вмешательство может также повредить молочные протоки и нервы в области сосков и ареол.
Функциональные трудности грудного вскармливания нервной системы, если разрезалочные протоки или иннервирующие грудь, или если молочные железы были повреждены. иначе повреждены. Поражение молочных протоков возникает чаще, если надрезы разрезают ткань около соска. Молочные железы чаще всего поражаются подкожными имплантатами (под железой) и грудными имплантатами большого размера, которые защемляют молочные протоки и препятствуют оттоку молока. Грудные имплантаты небольшого размера и подмышечная имплантация вызывает меньше проблем с функцией; однако невозможно предсказать, может ли женщина, перенесшая увеличение груди, успешно кормить грудью, поскольку некоторые не кормят грудью после периареолярного введения, некоторые не кормят грудью после увеличения груди с помощью субмышечных и других типов хирургических вмешательств.
 Маммограф нормальной груди (слева); маммограф злокачественной груди (справа).
Маммограф нормальной груди (слева); маммограф злокачественной груди (справа). Наличие рентгенологически непрозрачных грудных имплантатов (физиологический раствор или силикон) может повлиять на радиографическую чувствительность маммографа, то есть на изображении может быть не какой-либо опухоли (опухоли). В этом случае требуется подтверждение наличия или отсутствия раковой опухоли, при этом грудной имплант вручную перемещается к грудной стенке, а грудь вытягивается вперед, так что маммограф может визуализировать больший объем. внутренних тканей; Тем не менее, примерно одна треть ткани груди остается неадекватно визуализированной, что приводит к увеличению числа маммограмм с ложноотрицательными результатами.
рак груди изучает «Рак увеличенной груди: диагноз» и «Прогноз» (1993) и «Рак груди после увеличивающей маммопластики» (2001) у женщин с протезами на грудных имплантатах не сообщили о значительных различиях в стадиях заболевания на момент постановки диагноза рака; прогнозов аналогичных групп женщин, при этом пациенты с расширенными группами имеют более низкий риск последующего рецидива рака или смерти. И наоборот, использование имплантатов для реконструкции груди после рака мастэктомии, по-видимому, не оказывает отрицательного влияния на частоту смертей, связанных с раком. Тот факт, что у пациентов с имплантатами груди чаще диагностируются пальпируемые, но не более крупные опухоли, указывает на то, что опухоли такого же размера легче прощупываются у пациентов с увеличенной грудной клеткой, что может компенсировать улучшение изображения на маммограмме. Легкая пальпация опухоли (опухолей) рака молочной железы является следствием истончения ткани молочной железы, уменьшающей размер априори (потому что они имеют меньшие объемы ткани), и что имплант служит рентгеноконтрастным основанием, против которого раковую опухоль можно дифференцировать.
Имплант не груди имеет клинического значения для лампэктомии операции по сохранению груди у женщин, у которых после имплантации развился рак груди, процедура грудной имплант не мешает лечению внешним лучевым излучением (XRT); кроме того, частота фиброза ткани молочной железы после лечения является обычным явлением, и, как следствие, повышенной частотой капсулярной контрактуры. Существуют предварительные данные о том, что у женщин, перенесших увеличение груди, прогноз рака груди хуже. Использование имплантатов для реконструкции груди после рака груди мастэктомии, по-видимому, не оказывает отрицательного воздействия на смерть, связанное с раком.
 Винченц Черни (1842–1842) 1916), пионерская хирургия реконструкции груди.
Винченц Черни (1842–1842) 1916), пионерская хирургия реконструкции груди.С конца девятнадцатого века грудные имплантаты использовались для хирургического увеличение размера (объема), изменение формы (контур) и улучшение ощущения (тактичности) женской груди. В 1895 году хирург Винц Черни осуществил самую раннюю установку грудного имплантата, используя аутологичную жировую ткань, взятую из доброкачественной поясничной липомы, чтобы исправить асимметрию груди, из которой он удалил опухоль. В 1889 году хирург Роберт Герсуни экспериментировал с инъекциями парафина, получив катастрофические результаты из-за распада парафина на более мелкие тела после процедуры.
Из В первой половине двадцатого века врачи использовали другие вещества в качестве наполнителей грудных имплантатов - слоновую кость, стеклянные шарики, измельченный каучук, ox хрящ, терилен шерсть, гуттаперча, Dicora, полиэтилен чипсы, Ivalon (поливиниловый спирт - полимерная губка из формальдегида), полиэтиленовый мешок с Ivalon, пенополиэфир губка (Эфирон), полиэтиленовые ленты (Полистан), намотанные в клубок, полиэстер (губка из пенополиуретана), эластичный каучук и тефлон-силиконовые протезы.
В середине двадцатого века, Мортон И. Берсон в 1945 году и Жак Малиниак в 1950 году выполняли увеличение груди с помощью лоскута, вращая ткань грудной стенки пациента в грудь, чтобы увеличить ее объем. Кроме того, на протяжении 1950-х и 1960-х годов пластические хирурги использовали синтетические наполнители, в том числе силиконовые инъекции, полученные примерно 50 000 женщин, у которых развились силиконовые гранулемы и уплотнение груди, которое потребовало лечения мастэктомия. В 1961 году американские пластические хирурги Томас Кронин и Фрэнк Джероу и Dow Corning Corporation разработали первый силиконовый протез груди, заполненный силиконовым гелем; со временем первая увеличивающая маммопластика была проведена в 1962 году с использованием имплантата Cronin – Gerow, модель протеза 1963 года. В 1964 году французская компания Laboratoires Arion разработала и изготовила физиологический имплантат груди, заполненный физиологическим раствором, а затем представили для использования в качестве медицинского устройства в 1964 году.
В 1988 году, через двадцать шесть лет после появления в 1962 году грудных имплантатов, заполненных силиконовым гелем, США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) исследовало отказы грудных имплантатов и последующие осложнения и переклассифицировало устройства грудных имплантатов как медицинские устройства класса III и потребовало от производителей документальных данных, подтверждающих безопасность и эффективность. своих устройств для имплантации груди. В 1992 году FDA наложило мораторий на силиконовые грудные имплантаты в США, потому что не было «адекватной информации, подтверждающей безопасность и эффективность грудных имплантатов». Тем не менее, медицинский доступ к устройствам с силиконовым гелевым имплантатом продолжался для клинических исследований после мастэктомии реконструкции груди, коррекции врожденных деформаций и замены разорванных силиконовых гелевых имплантатов. FDA потребовало от производителей данных клинических испытаний и разрешило им предоставлять грудные имплантаты пациентам с увеличением груди для статистических исследований, требуемых Управлением по контролю за продуктами и лекарствами США. В середине 1992 года FDA одобрило дополнительный протокол исследования имплантатов, заполненных силиконовым гелем, для пациентов с реконструкцией груди и для пациентов, перенесших повторную операцию. Также в 1992 г. Dow Corning Corporation, производитель силиконовых изделий и грудных имплантатов, объявила о прекращении производства пяти силиконов, пригодных для имплантатов, но продолжит производство 45 других, медицинских силиконовые материалы - три года спустя, в 1995 году, корпорация Dow Corning обанкротилась , столкнувшись с крупными групповыми исками, заявившими о различных заболеваниях.
 Министерство здравоохранения и социальных служб США подтверждает, что научные, медицинские и клинические данные о медицинских устройствах.
Министерство здравоохранения и социальных служб США подтверждает, что научные, медицинские и клинические данные о медицинских устройствах. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США установило возрастные рамки для женщин, которым требуются грудные имплантаты; для реконструкции груди имплантаты с силиконовым гелем и солевым раствором были одобрены для женщин всех возрастов; для увеличения груди разрешены имплантаты с солевым раствором для женщин в возрасте 18 лет и старше; силиконовые имплантаты одобрены для женщин от 22 лет и старше. Поскольку каждое устройство грудного имплантата влечет за собой различные медицинские риски, минимальный возраст пациента для имплантатов груди с физиологическим раствором отличается от минимального возраста пациента для силиконовых имплантатов груди - из-за утечки наполнителя и риска бесшумного разрываоболочки; Таким образом, периодические скрининговые МРТ обследования являются рекомендуемой послеоперационной терапией для последующего наблюдения за пациентом. В других странах, в Европе и Океании, политика национального министерства здравоохранения по имплантации грудных имплантатов не одобряет периодическое обследование МРТ бессимптомных пациентов, но предлагает собственно пальпацию - с ультразвуковым скринингом или без него - чтобы было достаточно после оперативная терапия для большинства пациентов.
| На сайте Wikimedia Commons есть СМИ, связанные с грудными имплантатами. |