 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1,1'-Бифенил | |
| Другие названия Бифенил. Фенилбензол | |
| Идентификаторы | |
| Номер CAS | |
| 3D модель (JSmol ) | |
| 3DMet | |
| Ссылка Beilstein | 1634058 |
| ChEBI | |
| ChEMBL |
|
| ChemSpider | |
| ECHA InfoCard | 100.001.967 |
| Номер ЕС |
|
| Номер E | E230 (консерванты) |
| Справочник Гмелина | 3808 |
| KEGG | |
| PubChem CID | |
| номер RTECS |
|
| UNII | |
| Номер ООН | 3077 |
| Панель управления CompTox (EPA ) | |
InChI
| |
УЛЫБАЕТСЯ
| |
| Свойства | |
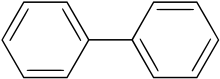
| Химическая формула | C12H10 |
| Молярная масса | 154,212 г · моль |
| Внешний вид | От бесцветных до бледно-желтых кристаллов |
| Запах | приятный |
| Плотность | 1,04 г / см |
| Температура плавления | 69,2 ° C (156,6 ° F; 342,3 K) |
| Температура кипения | 255 ° C (491 ° F; 528 K) |
| Растворимость в воде | 4,45 мг / л |
| Давление пара | 0,005 мм рт. Ст. (20 ° C) |
| Магнитная восприимчивость (χ) | -103,25 · 10 см / моль |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| Краткие сведения об опасностях GHS | H315, H319, H335, H400, H410 |
| Меры предосторожности GHS | P261, P264, P271, P273, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P391, P403 + 233, P405, P501 |
| NFPA 704 (огненный алмаз) |  1 1 0 1 1 0 |
| Температура вспышки | 113 ° C (235 ° F; 386 K) |
| Температура самовоспламенения. | 540 ° C (1004 ° F; 813 K) |
| Пределы взрываемости | 0,6– 5,8% |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 2400 мг / кг (перорально, кролик). 3280 мг / кг (перорально, крыса). 1900 мг / кг (перорально, мышь). 2400 мг / кг (перорально, крыса) |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (допустимое) | TWA 1 мг / м (0,2 ppm) |
| REL (рекомендуется) | TWA 1 мг / м (0,2 ppm) |
| IDLH (Непосредственная опасность) | 100 мг / м |
| Если не указано иное, данные для материалов приведены в их стандарте состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки ink | |
Бифенил (также известный как дифенил, фенилбензол, 1,1'-бифенил, лимонен или BP ) представляет собой органическое соединение, образующее бесцветные кристаллы. В частности, в более ранней литературе соединения, содержащие функциональную группу, состоящую из бифенила без одного водорода (сайт, к которому он присоединен), могут использовать префиксы ксенил или дифенилил .
. Имеет отчетливо приятный запах. Бифенил представляет собой ароматический углеводород с молекулярной формулой (C6H5)2. Он известен как исходный материал для производства полихлорированных дифенилов (ПХБ), которые когда-то широко использовались в качестве диэлектрических жидкостей и теплоносителей.
Бифенил также является промежуточным продуктом для производства множества других органических соединений, таких как эмульгаторы, оптические отбеливатели, урожай. защитные изделия и пластмассы. Бифенил нерастворим в воде, но растворим в типичных органических растворителях. Молекула бифенила состоит из двух связанных фенильных колец.
Бифенил естественным образом встречается в каменноугольной смоле, сырой нефти и природный газ и могут быть выделены из этих источников с помощью дистилляции. Его производят в промышленности как побочный продукт деалкилирования толуола с получением бензола :
. Другой основной путь - окислительный дегидрирование бензола :
Ежегодно этими способами производится 40 000 000 кг.
В лаборатории бифенил также может быть синтезирован обработкой фенилмагнийбромида солями меди (II).
Бифенил, не имея функциональных групп, практически не реагирует, что является основой его основного применения. В лаборатории бифенил в основном используется в качестве теплоносителя в виде эвтектической смеси с дифениловым эфиром. Эта смесь устойчива до 400 ° C.
Бифенил действительно подвергается сульфированию, которое с последующим гидролизом основанием дает п-гидроксибифенил и п, п'-дигидроксибифенил, которые являются полезными фунгицидами. В других реакциях замещения он подвергается галогенированию. Полихлорированные бифенилы когда-то были популярными пестицидами.
Бифенил лития содержит анион-радикал, который является сильно восстанавливающим (-3,1 В по сравнению с Fc). Некоторые сольваты солей бифенильного аниона щелочных металлов охарактеризованы рентгеновской кристаллографией. Эти соли, обычно получаемые на месте, являются универсальными восстановителями. Бифенил лития обладает некоторыми преимуществами по сравнению с родственным нафтенидом лития. К Li / бифенилу относится производное с двумя трет-бутильными группами на бифениле.
Вращение вокруг одинарной связи в бифениле, и особенно его орто-замещенный производные, стерически затруднены. По этой причине некоторые замещенные бифенилы проявляют атропоизомерию ; то есть отдельные C 2-симметричные -изомеры являются оптически стабильными. Некоторые производные, а также родственные молекулы, такие как BINAP, находят применение в качестве лигандов в асимметричном синтезе. В случае незамещенного бифенила равновесный угол скручивания составляет 44,4 °, а торсионные барьеры довольно малы, 6,0 кДж / моль при 0 ° и 6,5 кДж / моль при 90 °. Добавление орто-заместителей значительно увеличивает барьер: в случае 2,2'-диметильного производного барьер составляет 17,4 ккал / моль (72,8 кДж / моль).
Бифенил предотвращает рост плесени и грибка и поэтому используется в качестве консерванта (E230 в сочетании с E231, E232 и E233), особенно при сохранении цитрусовых фруктов во время транспортировки. Он больше не одобрен в качестве пищевой добавки в Европейском Союзе.
Он умеренно токсичен, но может биологически разлагаться путем преобразования в нетоксичные соединения. Некоторые бактерии способны гидроксилировать бифенил и его полихлорированные бифенилы (ПХБ).
Он входит в активную группу антибиотика оритаванцин.
Замещенные бифенилы имеют множество применений. Их получают различными реакциями сочетания, включая реакцию Сузуки-Мияуры и реакцию Ульмана. Полихлорированные дифенилы когда-то использовались в качестве охлаждающих и изолирующих жидкостей, а полибромированные дифенилы являются антипиренами. Бифенильный мотив также присутствует в лекарственных средствах, таких как дифлунизал и телмисартан. Аббревиатура E7 означает смесь жидких кристаллов, состоящую из нескольких цианобифенилов с длинными алифатическими хвостами, коммерчески используемых в жидкокристаллических дисплеях (5CB, а также). В красителях и полимерах используются различные бензидиновые производные. Исследования кандидатов в жидкие кристаллы бифенилов в основном сосредоточены на молекулах с сильно полярными головками (например, циано- или галогенидными группами) и алифатическими хвостами.