 Представление трехмерной структуры миоглобина, показывающее альфа-спирали, представленные лентами. Этот белок был первым, чья структура была определена рентгеновской кристаллографией Максом Перуцем и сэром Джоном Каудери Кендрю в 1958 году, за что они получили Нобелевская премия по химии.
Представление трехмерной структуры миоглобина, показывающее альфа-спирали, представленные лентами. Этот белок был первым, чья структура была определена рентгеновской кристаллографией Максом Перуцем и сэром Джоном Каудери Кендрю в 1958 году, за что они получили Нобелевская премия по химии.A биомолекула или биологическая молекула - это широко используемый термин для молекул, присутствующих в организмах, которые необходимы для одного или более типично биологические процессы, такие как деление клетки, морфогенез или развитие. Биомолекулы включают большие макромолекулы (или полианионы), такие как белки, углеводы, липиды и нуклеиновые кислоты, а также небольшие молекулы, такие как первичные метаболиты, вторичные метаболиты и натуральные продукты. Более общее название этого класса материалов - биологические материалы. Биомолекулы являются важным элементом живых организмов, эти биомолекулы часто являются эндогенными, производятся внутри организма, но организмам обычно нужны экзогенные биомолекулы, например определенные питательные вещества, чтобы выжить.
Биология и ее подразделы биохимия и молекулярная биология изучают биомолекулы и их реакции. Большинство биомолекул - это органические соединения, и всего четыре элемента - кислород, углерод, водород и азот - составляют 96% от массы человеческого тела. Но многие другие элементы, такие как различные биометаллы, присутствуют в небольших количествах.
Однородность обоих конкретных типов молекул (биомолекул) и определенных метаболических путей являются неизменными характеристиками среди широкого разнообразия форм жизни; таким образом, эти биомолекулы и метаболические пути называются «биохимическими универсалиями» или «теорией материального единства живых существ», объединяющей концепцией в биологии, наряду с теорией клеток и теорией эволюции.
Существуют разнообразные биомолекулы, в том числе:
| Биомономеры | Биоолиго | Биополимеры | Полимеризация процесс | Ковалентная связь название между мономерами |
|---|---|---|---|---|
| Аминокислоты | Олигопептиды | Полипептиды, белки (гемоглобин...) | Поликонденсация | Пептидная связь |
| Моносахариды | Олигосахариды | Полисахариды (целлюлоза...) | Поликонденсация | Гликозидная связь |
| Изопрен | Терпены | Политерпены: цис-1,4-полиизопрен натуральный каучук и транс-1,4- полиизопрен гуттаперча | Полисоединение | |
| Нуклеотиды | Олигонуклеотиды | Полинуклеотиды, нуклеиновые кислоты (ДНК, РНК ) | Фосфодиэфирная связь |
Нуклеозиды - это молекулы, образованные присоединением азотистого основания к рибозному или дезоксирибозному кольцу. Примеры из них включают цитидин (C), уридин (U), аденозин (A), гуанозин (G) и тимидин (T).
Нуклеозиды могут быть фосфорилированы специфическими киназами в клетке, продуцируя нуклеотиды. И ДНК, и РНК представляют собой полимеры, состоящие из длинных линейных молекул, собранных ферментами полимераза из повторяющихся структурных единиц или мономеров мононуклеотиды. ДНК использует дезоксинуклеотиды C, G, A и T, в то время как РНК использует рибонуклеотиды (которые имеют дополнительную гидроксильную (OH) группу в пентозном кольце) C, G, A и U. Модифицированные основания довольно распространены (например, с метильными группами в основном кольце), как обнаружено в рибосомной РНК или переносящих РНК, или для отличия новых цепей ДНК от старых после репликации.
Каждый нуклеотид состоит из ациклического азотистого основания, пентозы и от одной до трех фосфатных групп. Они содержат углерод, азот, кислород, водород и фосфор. Они служат источниками химической энергии (аденозинтрифосфат и гуанозинтрифосфат ), участвуют в клеточной передаче сигналов (циклический гуанозинмонофосфат и циклический аденозинмонофосфат ) и включены в важные кофакторы ферментативных реакций (кофермент A, флавинадениндинуклеотид, флавинмононуклеотид и никотинамидадениндинуклеотидфосфат ).
В структуре ДНК преобладает хорошо известная двойная спираль, образованная спариванием оснований Уотсона-Крика C с G и A с T. Это известно как B-форма ДНК и в подавляющем большинстве случаев является наиболее благоприятным и распространенным состоянием ДНК; его высокоспецифичные и стабильные пары оснований являются основой надежной генетической информации ДНК может иногда встречаться в виде одиночных цепей (часто требующих стабилизации одноцепочечными связывающими белками) или в виде спиралей А-формы или Z-формы, а иногда и m или сложные трехмерные структуры, такие как кроссовер в соединениях Холлидея во время репликации ДНК.
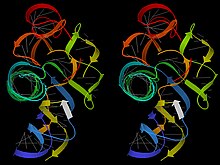 Стерео трехмерное изображение рибозима интрона группы I (файл PDB 1Y0Q); серые линии показывают пары оснований; ленточные стрелки показывают области двойной спирали, от синего до красного от конца 5 до 3 футов; белая лента представляет собой продукт РНК.
Стерео трехмерное изображение рибозима интрона группы I (файл PDB 1Y0Q); серые линии показывают пары оснований; ленточные стрелки показывают области двойной спирали, от синего до красного от конца 5 до 3 футов; белая лента представляет собой продукт РНК. РНК, напротив, образует большие и сложные трехмерные третичные структуры, напоминающие белки, а также отдельные отдельные нити с локально сложенными участками, которые составляют молекулы матричной РНК. Эти структуры РНК содержат множество участков двойной спирали А-формы, соединенных в определенные трехмерные структуры однонитевыми петлями, выпуклостями и соединениями. Примерами являются тРНК, рибосомы, рибозимы и рибопереключатели. Этим сложным структурам способствует тот факт, что остов РНК обладает меньшей локальной гибкостью, чем ДНК, но большим набором различных конформаций, по-видимому, из-за как положительных, так и отрицательных взаимодействий дополнительных ОН с рибозой. Структурированные молекулы РНК могут связываться с другими молекулами с высокой степенью специфичности и сами могут специфически распознаваться; кроме того, они могут выполнять ферментативный катализ (когда они известны как «рибозимы », как первоначально обнаружили Том Чех и его коллеги).
Моносахариды представляют собой простейшую форму углеводов с одним простым сахаром. По существу, они содержат в своей структуре альдегидную или кетонную группу. Присутствие альдегидной группы в моносахариде обозначается префиксом альдо-. Точно так же кетоновая группа обозначается префиксом кето-. Примерами моносахаридов являются гексозы, глюкоза, фруктоза, триозы, тетрозы, гептозы, галактоза, пентоза, рибоза и дезоксирибоза. Потребляемые фруктоза и глюкоза имеют разную скорость опорожнения желудка, по-разному всасываются и имеют разные метаболические судьбы, что дает 2 различных сахарида возможности по-разному влиять на потребление пищи. Большинство сахаридов в конечном итоге обеспечивают топливо для клеточного дыхания.
Дисахариды образуются, когда два моносахарида или два простых сахара образуют связь при удалении воды. Их можно гидролизовать, чтобы получить строительные блоки сахарина, путем кипячения с разбавленной кислотой или их реакции с соответствующими ферментами. Примеры дисахаридов включают сахарозу, мальтозу и лактозу.
. Полисахариды представляют собой полимеризованные моносахариды или сложные углеводы. В них есть несколько простых сахаров. Примерами являются крахмал, целлюлоза и гликоген. Они, как правило, большие и часто имеют сложную разветвленную связь. Из-за своего размера полисахариды не растворимы в воде, но их многие гидроксильные группы гидратируются индивидуально при воздействии воды, а некоторые полисахариды образуют густые коллоидные дисперсии при нагревании в воде. Более короткие полисахариды, содержащие от 3 до 10 мономеров, называются олигосахаридами. Для распознавания сахаридов был разработан флуоресцентный датчик молекулярного импринтинга замещения индикатора. Он успешно выделил три марки напитка из апельсинового сока. Изменение интенсивности флуоресценции получаемых в результате сенсорных пленок напрямую связано с концентрацией сахарида.
Лигнин представляет собой сложную полифенольную макромолекулу, состоящую в основном из бета-O4-арильных связей. После целлюлозы лигнин является вторым по распространенности биополимером и одним из основных структурных компонентов большинства растений. Он содержит субъединицы, полученные из п-кумарилового спирта, кониферилового спирта и синапилового спирта, и необычен среди биомолекул, поскольку он рацемический. Отсутствие оптической активности связано с полимеризацией лигнина, которая происходит посредством реакций свободнорадикального сочетания, в которых нет предпочтения какой-либо конфигурации в хиральном центре.
Липиды (маслянистые) представляют собой главным образом сложные эфиры жирных кислот и являются основными строительными блоками биологических мембран. Другая биологическая роль - хранение энергии (например, триглицеридов ). Большинство липидов состоят из полярной или гидрофильной головки (обычно глицерин) и от одного до трех неполярных или гидрофобных хвостов жирных кислот, и поэтому они амфифильный. Жирные кислоты состоят из неразветвленных цепей атомов углерода, которые связаны только одинарными связями (насыщенные жирные кислоты) или как одинарными, так и двойными связями (ненасыщенными жирные кислоты). Цепи обычно состоят из 14-24 углеродных групп, но это всегда четное число.
Для липидов, присутствующих в биологических мембранах, гидрофильная головка относится к одному из трех классов:
Другие липиды включают простагландины и лейкотриены, которые представляют собой 20-углеродные жирные ацильные единицы, синтезированные из арахидоновой кислоты. Они также известны как жирные кислоты
Аминокислоты, содержащие функциональные группы амино и карбоновых кислот . (В биохимии термин «аминокислота» используется для обозначения тех аминокислот, в которых амино- и карбоксилатные функциональные группы присоединены к одному и тому же атому углерода, плюс пролин, который на самом деле не является аминогруппой. кислота).
Модифицированные аминокислоты иногда встречаются в белках; обычно это результат ферментативной модификации после трансляции (синтез белка ). Например, фосфорилирование серина киназами и дефосфорилирование фосфатазами является важным механизмом контроля в клеточном цикле. Известно, что только две аминокислоты, кроме стандартных двадцати, включаются в белки во время трансляции у некоторых организмов:
Помимо тех, которые используются в синтезе белка, другие биологически важные аминокислоты включают карнитин (используется для транспорта липидов внутри клетки), орнитин, ГАМК и таурин.
Конкретный ряд аминокислот, которые форма белка известна как первичная структура этого белка. Эта последовательность определяется генетическим составом человека. Он определяет порядок групп боковых цепей вдоль «остова» линейного полипептида.
Белки имеют два типа хорошо классифицированных, часто встречающихся элементов локальной структуры, определяемых особым паттерном водородных связей вдоль основной цепи: альфа-спираль и бета-лист. Их количество и расположение называется вторичной структурой белка. Альфа-спирали представляют собой регулярные спирали, стабилизированные водородными связями между CO-группой основной цепи (карбонил ) одного аминокислотного остатка и NH-группой основной цепи (амид ) остатка i + 4. Спираль содержит около 3,6 аминокислот на оборот, а боковые цепи аминокислот выступают из цилиндра спирали. Бета-гофрированные листы образованы водородными связями основной цепи между отдельными бета-нитями, каждая из которых находится в «вытянутой» или полностью вытянутой конформации. Пряди могут лежать параллельно или антипараллельно друг другу, а направление боковой цепи чередуется выше и ниже листа. Гемоглобин содержит только спирали, натуральный шелк состоит из бета-складчатых листов, а многие ферменты имеют структуру чередующихся спиралей и бета-цепей. Элементы вторичной структуры соединены участками "петли" или "клубков" неповторяющейся структуры, которые иногда бывают довольно подвижными или неупорядоченными, но обычно принимают четко определенное, стабильное расположение.
В целом компактный, 3D структура белка называется его третичной структурой или его «складкой». Он образуется в результате различных сил притяжения, таких как водородная связь, дисульфидные мостики, гидрофобные взаимодействия, гидрофильные взаимодействия, ван сила дер Ваальса и т. д.
Когда две или более цепочки полипептида (одинаковой или различной последовательности) группируются с образованием белка, четвертичная структура белка образуется. Четвертичная структура - это атрибут полимерных (цепи с одинаковой последовательностью) или гетеромерных (цепи с разными последовательностями) белков, таких как гемоглобин, который состоит из двух «альфа» и две полипептидные цепи «бета».
апофермент (или, как правило, апопротеин) представляет собой белок, не связанный с какими-либо низкомолекулярными кофакторами, субстратами или ингибиторами. Он часто важен как неактивная форма хранения, транспортировки или секретирования белка. Это требуется, например, для защиты секреторной клетки от активности этого белка. Апоферменты становятся активными ферментами при добавлении кофактора . Кофакторы могут быть неорганическими (например, ионы металлов и кластеры железо-сера ) или органическими соединениями (например, [группа флавина | флавин] и гем ). Органические кофакторы могут быть либо простетическими группами, которые прочно связаны с ферментом, либо коферментами, которые высвобождаются из активного центра фермента во время реакции.
Изоферменты, или изоферменты, представляют собой множественные формы фермента с несколько отличающейся последовательностью белка и очень похожими, но обычно не идентичными функциями. Они либо продукты разных генов, либо разные продукты альтернативного сплайсинга. Они могут либо продуцироваться в разных органах или типах клеток для выполнения одной и той же функции, либо несколько изоферментов могут продуцироваться в одном и том же типе клеток при дифференциальной регуляции в соответствии с потребностями изменения развития или окружающей среды. ЛДГ (лактатдегидрогеназа ) имеет несколько изоферментов, в то время как фетальный гемоглобин является примером регулируемой в процессе развития изоформы неферментативного белка. Относительные уровни изоферментов в крови можно использовать для диагностики проблем в органе секреции.