Реакция Бэмфорда – Стивенса - это химическая реакция, посредством которой обрабатывается тозилгидразоны с сильным основанием дают алкены. Он назван в честь британского химика и шотландского химика Томаса Стивенса Стивенса (1900–2000). Использование апротонных растворителей дает преимущественно Z- алкены, тогда как протонный растворитель дает смесь E- и Z-алкенов. В качестве превращения с образованием алкена реакция Бэмфорда-Стивенса имеет широкое применение в методологии синтеза и синтезе сложных молекул.

Обработка тозилгидразонов алкиллитиевыми реагентами называется реакцией Шапиро.
Первой стадией реакции Бэмфорда-Стивенса является образование диазосоединения 3.

В протонных растворителях диазосоединение 3 разлагается до ион карбения 5.

В апротонных растворителях диазосоединение 3 разлагается до карбена 7.

Реакция Бэмфорда-Стивенса не оказалась полезной для стереоселективного образования алкенов посредством термического разложения металлизированных тозилгидразонов за счет неизбирательного происходит 1,2-перегруппировка карбенового центра, дающая смесь продуктов. Путем замены алкильной группы триметилсилильной (TMS) группой на N-азиридинилиминах можно усилить миграцию конкретного атома водорода. С бета-атомом кремния в H, стереоэлектронный эффект σ C-Si → σ CH ослабляет связь CH, в результате исключительная миграция и приводящая к почти исключительному образованию аллилсиланов вместо равных количеств аллилсиланов и изомерных гомоаллилсиланов, аналогично смеси продуктов, наблюдаемых в случае диалкила, или других продуктов внедрения (например, циклопропанов). См. эффект бета-кремния.
N-тозилгидразоны можно использовать во множестве синтетических процедур. Их использование с аринами было использовано для получения 3-замещенных индазолов двумя предложенными путями. Первым шагом является депротонирование гидразона диазосоединений с использованием CsF. На этом этапе конъюгатное основание может либо разложиться с образованием диазосоединения и претерпеть [3 + 2] диполярное циклоприсоединение с арином с образованием продукта, либо [3+ 2] аннулирование арином, которое также дало бы конечный продукт. В то время как сильные основания, такие как LiOtBu и Cs 2CO3, часто используются в этой химии, CsF был использован для облегчения образования аринов in situ из о- (триметилсилил) арилтрифлатов. Также считалось, что CsF является достаточно основным для депротонирования N-тозилгидразона.
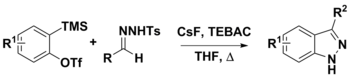
Барлуенга и его коллеги разработали первый пример использования N-тозилгидразонов в качестве нуклеофильные партнеры в реакциях кросс-сочетания. Обычно нуклеофильные реагенты в реакциях сочетания, как правило, относятся к металлоорганическому разнообразию, а именно, магнийорганический, -цинк, -олово, -кремний и -бор. В сочетании с электрофильными арилгалогенидами N-тозилгидразоны могут быть использованы для получения полизамещенных олефинов в условиях катализируемого палладием без использования зачастую дорогостоящих и сложных в синтетическом отношении металлоорганических реагентов..
Объем реакции широк. ; N-тозилгидразоны, полученные из альдегидов и кетонов, хорошо переносятся, что приводит к образованию как ди-, так и тризамещенных олефинов. Кроме того, различные арилгалогениды хорошо переносятся в качестве партнеров по связыванию, включая те, которые содержат как электроноакцепторные, так и электронодонорные группы, а также π-богатые и π-дефицитные ароматические гетероциклические соединения. Стереохимия - важный элемент, который следует учитывать при получении полизамещенных олефинов. Использование гидразонов, полученных из линейных альдегидов, привело к исключительно транс-олефинам, в то время как стереохимические результаты тризамещенных олефинов зависели от размера заместителей..

Считается, что механизм этого превращения протекает аналогично синтезу алкенов с помощью реакция Бэмфорда – Стивенса; разложение N-тозилгидразонов в присутствии основания с образованием диазосоединений, которые затем выделяют газообразный азот с образованием карбена, который затем можно гасить с помощью электрофила. В этом случае реакция сочетания начинается с окислительного добавления арилгалогенида к катализатору Pd с образованием арил-Pd комплекса. Реакция диазосоединения, полученного из гидразона, с комплексом Pd дает комплекс Pd-карбен. мигрирующая вставка арильной группы дает комплекс алкил-Pd, который подвергается отщеплению син бета-гидрида с образованием транс-арилолефина и регенерации катализатора Pd. Эта реакция также оказалась полезной при получении конъюгированных енинов из N-тозилгидразонов и концевых алкинов в аналогичных условиях реакции, катализируемой Pd, и по тому же механизму..

Кроме того, Барлуенга и его коллеги продемонстрировали трехкомпонентную реакцию связывания альдегидов в одном реакторе. или кетоны, тозилгидразиды и арилгалогениды, в которых N-тозилгидразон образуется in situ. Этот процесс дает стереоселективные олефины с выходами, аналогичными процессу, в котором используются предварительно полученные N-тозилгидразоны.
Барлуенга и его сотрудники также разработали методологию безметаллового восстановительного связывания N-тозилгидразонов с бороновыми кислотами. Реакция допускает наличие множества функциональных групп на обоих субстратах, включая ароматические, гетероароматические, алифатические, электронодонорные и электроноакцепторные заместители, и протекает с высокими выходами в присутствии карбоната калия. Считается, что реакция протекает через образование диазосоединения, которое образуется из соли гидразона. Затем диазосоединение может реагировать с бороновой кислотой с образованием бензилбороновой кислоты через промежуточный боронат. Альтернативный путь состоит из образования бензилбороновой кислоты через цвиттерионный промежуточный продукт с последующим протодеборированием бензилбороновой кислоты в основных условиях, что приводит к конечному продукту восстановления.

Эта методология также была распространена на гетероатомные нуклеофилы для получения простых и тиоэфиров.
Новый процесс был разработан Штольцем в которой реакция Бэмфорда-Стивенса была объединена с перегруппировкой Клайзена с получением различных олефиновых продуктов. Это превращение происходит сначала путем термического разложения N-азиридинилгидразонов с образованием диазосоединения (1 ), за которым следует родий-опосредованная де-диазотизация (2 ) и син 1, 2- гидридный сдвиг (3). Этот субстрат подвергается термической алифатической перегруппировке Клайзена (4) с получением продукта.

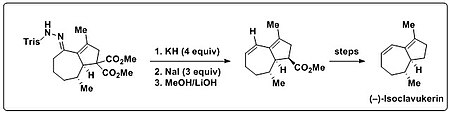
Trost et al. использовали реакцию Бэмфорда-Стивенса в своем общем синтезе (-) - изоклавукерина для введения диеновой части, обнаруженной в природном продукте. Бициклический трисилгидразон первоначально был подвергнут реакции Шапиро (алкиллитий или LDA), что привело только к не поддающимся описанию продуктам разложения. Однако когда на этот бициклический трисилгидразон воздействовали сильным основанием (KH) и нагреванием, образовывался желаемый диеновый продукт. Более того, было показано, что образование олефинов и последующее декарбоксилирование можно проводить в одном резервуаре. С этой целью добавляли избыток NaI вместе с повышением температуры для облегчения декарбоксилирования Крапчо.