| Окисление Байера-Виллигера | |
|---|---|
| Названо в честь | Адольфа фон Байера. Виктора Виллигера |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Байер-Виллигер-окисление |
| RSC ID онтологии | RXNO: 0000031 |
Окисление Байера-Виллигера представляет собой органическую реакцию, в которой образуется сложный эфир из кетона или лактон из циклического кетона с использованием пероксикислоты или пероксиды в качестве окислителя. Реакция названа в честь Адольфа фон Байера и Виктора Виллигера, которые впервые сообщили о реакции в 1899 году.
 Окисление Байера-Виллигера
Окисление Байера-Виллигера На первом этапе механизм реакции, пероксикислота протонирует кислород карбонильной группы. Это делает карбонильную группу более восприимчивой к атаке пероксикислоты. Затем пероксикислота атакует углерод карбонильной группы, образуя так называемое промежуточное соединение Криджи. Посредством согласованного механизма один из заместителей в кетоне мигрирует к кислороду пероксидной группы, тогда как карбоновая кислота уходит. Этот этап миграции считается этапом определения скорости. Наконец, депротонирование иона оксокарбения дает сложный эфир.
 . Механизм реакции окисления Байера-Виллигера
. Механизм реакции окисления Байера-Виллигера Считается, что продукты окисления Байера-Виллигера контролируются как первичными, так и вторичными стереоэлектронными эффектами. Первичный стереоэлектронный эффект в окислении Байера-Виллигера относится к необходимости, чтобы связь кислород-кислород в пероксидной группе была антиперипланарной группой, которая мигрирует. Эта ориентация способствует оптимальному перекрытию 𝛔 орбитали мигрирующей группы с 𝛔 * орбиталью пероксидной группы. Вторичный стереоэлектронный эффект относится к необходимости того, чтобы неподеленная пара на кислороде гидроксильной группы была антиперипланарной по отношению к мигрирующей группе. Это обеспечивает оптимальное перекрытие кислородной несвязывающей орбитали с * -орбиталью мигрирующей группы. Этому этапу миграции также (по крайней мере in silico ) помогают две или три единицы пероксикислоты, позволяющие гидроксильному протону перемещаться в новое положение.
 Стереоэлектронные эффекты
Стереоэлектронные эффекты Способность к миграции оценивается как третичная>вторичный>арил>первичный. Аллильные группы более склонны к миграции, чем первичные алкильные группы, но в меньшей степени, чем вторичные алкильные группы. Отвлекающие электроны группы на заместителе снижают скорость миграции. Есть два объяснения этой тенденции в способности к миграции. Одно объяснение основывается на накоплении положительного заряда в переходном состоянии для разрушения промежуточного продукта Криджи (проиллюстрировано резонансной структурой карбокатион резонансной структурой промежуточного продукта Криджи). Имея в виду эту структуру, имеет смысл, что заместитель, который может лучше всего поддерживать положительный заряд, будет, скорее всего, мигрировать. Чем выше степень замещения, тем стабильнее обычно карбокатион. Таким образом, наблюдается тенденция «третичное>вторичное>первичное».
 Резонансные структуры промежуточного звена Криджи
Резонансные структуры промежуточного звена Криджи Другое объяснение использует стереоэлектронные эффекты и стерические аргументы. Как упоминалось, заместитель, который является антиперипланарным по отношению к пероксидной группе в переходном состоянии, будет мигрировать. Это переходное состояние имеет гош-взаимодействие между пероксикислотой и немигрирующим заместителем. Если более объемную группу разместить антиперипланарно по отношению к пероксидной группе, гош-взаимодействие между заместителем на образующемся сложном эфире и карбонильной группой пероксикислоты будет уменьшено. Таким образом, это более объемная группа, которая предпочтет быть антиперипланарной по отношению к пероксидной группе, что повысит ее способность к миграции.
 Пространственная масса, влияющая на миграцию
Пространственная масса, влияющая на миграцию Мигрирующая группа в ациклических кетонах обычно не является 1-градусной алкильной группой. Однако их можно убедить перейти в предпочтение к группам 2 ° или 3 °, используя CF 3CO3H или BF 3 + H 2O2в качестве реагентов.
В 1899 году Адольф Байер и Виктор Виллигер впервые опубликовали демонстрацию реакции, которая теперь известна как окисление Байера-Виллигера. Они использовали пероксимоносерную кислоту для получения соответствующих лактонов из камфары, ментона и тетрагидрокарвона.
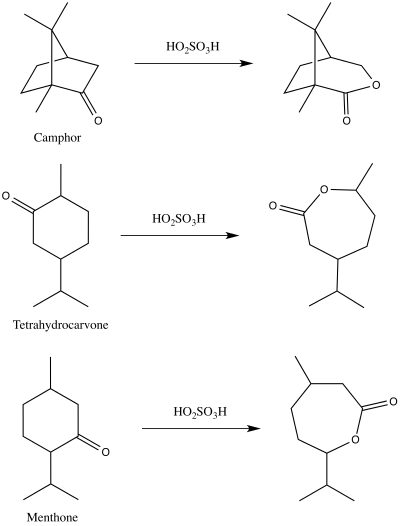 Исходные реакции, описанные Байером и Виллигером
Исходные реакции, описанные Байером и Виллигером три предложенных механизма реакции окисления Байера-Виллигера, которые, по-видимому, соответствовали наблюдаемым результатам реакции. Эти три механизма реакции действительно можно разделить на два пути атаки пероксикислоты - либо на кислород, либо на углерод карбонильной группы. Атака на кислород может привести к двум возможным промежуточным соединениям : Байер и Виллигер предложили промежуточное соединение диоксиран, в то время как Георг Виттиг и Густав Пипер предложили пероксид <171.>без образования диоксирана. Углеродная атака была предложена Рудольфом Криджи. На этом пути перкислота атакует карбонильный углерод, производя то, что сейчас известно как промежуточное соединение Криджи.
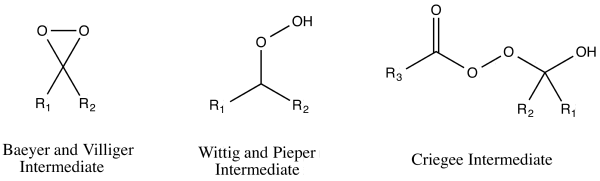 Предложенное промежуточное соединение окисления Байера-Виллигера
Предложенное промежуточное соединение окисления Байера-Виллигера В 1953 году Уильям фон Эггерс Деринг и Эдвин Дорфман выяснил правильный путь механизма реакции окисления Байера-Виллигера с помощью кислород-18 -метки бензофенона. Каждый из трех различных механизмов приведет к разному распределению маркированных продуктов. Промежуточный продукт Criegee приведет к продукту, маркированному только карбонильным кислородом. Продукт промежуточного соединения Виттига и Пипера мечен только на алкоксигруппе сложного эфира. Промежуточное соединение Байера и Виллигера приводит к распределению обоих вышеуказанных продуктов 1: 1. Результат эксперимента по маркировке подтвердил промежуточное звено Криджи, которое в настоящее время является общепринятым путем.
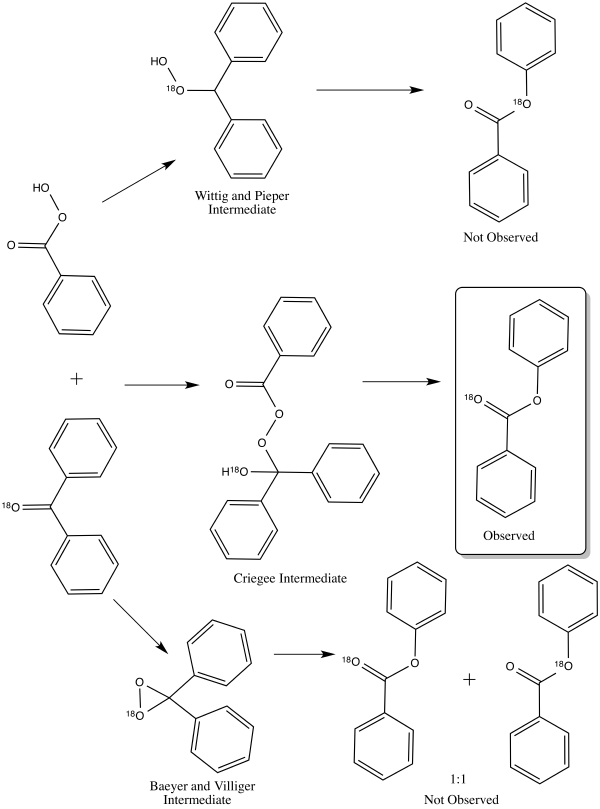 Различные возможные результаты эксперимента по маркировке Дорфмана и Деринга
Различные возможные результаты эксперимента по маркировке Дорфмана и Деринга Миграция не меняет стереохимия группы, которая переносит, например: она стереореактивна .
Хотя для окисления Байера-Виллигера используется много разных пероксикислот, некоторые из наиболее распространенных окислители включают мета-хлорпербензойную кислоту (mCPBA) и трифторпераксусную кислоту (TFPAA). Общая тенденция заключается в том, что более высокая реакционная способность коррелирует с более низкой pKa (то есть более высокой кислотностью) соответствующей карбоновой кислоты (или спирта в случае пероксидов). Следовательно, тенденция реакционной способности показывает TFPAA>4-нитропербензойная кислота>mCPBA и пермуравьиная кислота >перуксусная кислота >пероксид водорода >трет-бутилгидропероксид. Пероксиды гораздо менее активны, чем пероксикислоты. Для использования перекиси водорода даже требуется катализатор. Кроме того, использование органических пероксидов и пероксида водорода имеет тенденцию к увеличению побочной реакционной способности из-за их неразборчивости.
Использование пероксикислот и пероксидов при выполнении окисления Байера-Виллигера может вызвать нежелательное окисление других функциональных групп. Алкены и амины являются лишь некоторыми из группы, которые могут быть окислены. Например, алкены в субстрате, особенно богатые электронами, могут быть окислены до эпоксидов. Однако были разработаны методы, учитывающие переносимость этих функциональных групп. В 1962 году GB Payne сообщил, что использование перекиси водорода в присутствии катализатора селен приведет к получению эпоксида из алкенилкетонов, в то время как использование пероксиуксусной кислоты приведет к образованию сложного эфира.
 Payne сообщил, что разные реагенты дадут разные результаты при наличии более одной функциональной группы
Payne сообщил, что разные реагенты дадут разные результаты при наличии более одной функциональной группы Использование пероксида водорода в качестве окислителя будет выгодно, делая реакцию более экологически чистой, поскольку единственным побочным продуктом является вода. Сообщалось, что производные бензолселениновой кислоты в качестве катализаторов обладают высокой селективностью при использовании пероксида водорода в качестве окислителя. Другой класс катализаторов, которые демонстрируют высокую селективность по отношению к перекиси водорода в качестве окислителя, представляют собой твердые катализаторы на основе кислоты Льюиса, такие как станносиликаты. Среди станносиликатов, особенно зеотип Sn-бета и аморфный Sn-MCM-41, проявляют многообещающую активность и близкую к полной селективности в отношении желаемого продукта.
пытается использовать металлоорганические катализаторы для проведения энантиоселективного окисления Байера-Виллигера. В первом сообщенном случае одного такого окисления прохирального кетона в качестве окислителя использовался кислород с медным катализатором. Затем последовали и другие катализаторы, включая соединения платины и алюминия.
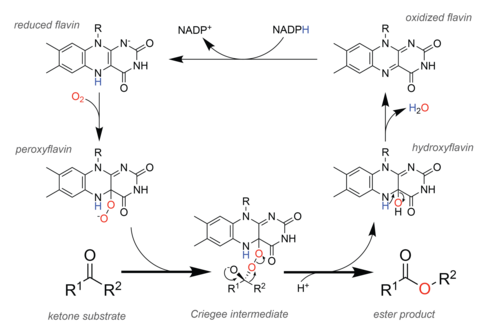 Механизм реакции кофактора флавина на катализатор реакции Байера-Виллигера в ферментах монооксигеназы Байера-Виллигера.
Механизм реакции кофактора флавина на катализатор реакции Байера-Виллигера в ферментах монооксигеназы Байера-Виллигера. В природе, ферменты, называемые монооксигеназами Байера-Виллигера (BVMO), осуществляют окисление аналогично химической реакции. Чтобы облегчить этот химический процесс, BVMO содержат флавинадениндинуклеотид (FAD) кофактор. В каталитическом цикле (см. Рисунок справа) клеточный окислительно-восстановительный эквивалент НАДФН сначала восстанавливает кофактор, что позволяет ему впоследствии реагировать с молекулярный кислород. Полученный пероксифлавин представляет собой каталитическое соединение, насыщающее кислородом субстрат, и теоретические исследования предполагают, что реакция протекает через то же промежуточное соединение Криджи, которое наблюдается в химической реакции. После стадии перегруппировки с образованием продукта сложного эфира остается гидроксифлавин, который самопроизвольно удаляет воду с образованием окисленного флавина, тем самым замыкая каталитический цикл.
BVMO тесно связаны с флавинсодержащими монооксигеназами (FMO), ферментами, которые также встречаются в организме человека и функционируют в рамках системы метаболической детоксикации первой линии печень вдоль монооксигеназ цитохрома P450. Фактически было показано, что человеческий FMO5 может катализировать реакции Байера-Виллигера, что указывает на то, что реакция может происходить и в организме человека.
BVMO широко изучались из-за их потенциала биокатализаторов, то есть для применения в органическом синтезе. Учитывая экологические проблемы для большинства химических катализаторов, использование ферментов считается более экологичной альтернативой. BVMO особенно интересны для применения, потому что они удовлетворяют ряду критериев, обычно требуемых в биокатализе: помимо их способности катализировать синтетически полезную реакцию, было обнаружено, что некоторые природные гомологи имеют очень большой объем субстрата (т.е. их реакционная способность не ограничивалась одним соединением, как это часто предполагается при ферментативном катализе), они могут быть легко получены в больших масштабах, а поскольку трехмерная структура многих BVMO была определена, ферментная инженерия может быть применена для получения вариантов с улучшенной термостабильностью и / или реакционной способностью. Еще одним преимуществом использования ферментов для реакции является их часто наблюдаемая регио- и энантиоселективность, обусловленная стерическим контролем ориентации субстрата во время катализа в пределах активного центра.
Зоапатанол - это биологически активная молекула, которая естественным образом встречается в растении зеопатле, которое использовалось в Мексике для приготовления чая, способного вызвать менструацию и роды. В 1981 году Винаяк Кейн и Дональд Дойл сообщили о синтезе зоапатанола. Они использовали окисление Байера-Виллигера, чтобы получить лактон, который послужил важным строительным блоком, который в конечном итоге привел к синтезу зоапатанола.
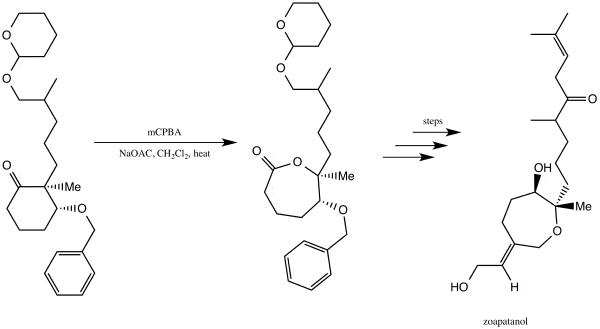 Кейн и Дойл использовали окисление Байера-Виллигера для синтеза зоапатанола
Кейн и Дойл использовали окисление Байера-Виллигера для синтеза зоапатанола В 2013 году Алина Швиздор сообщила о преобразовании стероида дегидроэпиандростерона в противораковое средство тестололактон с использованием окисления Байера-Виллигера, вызванного грибком, который продуцирует Байера. -Монооксигеназы Виллигера.
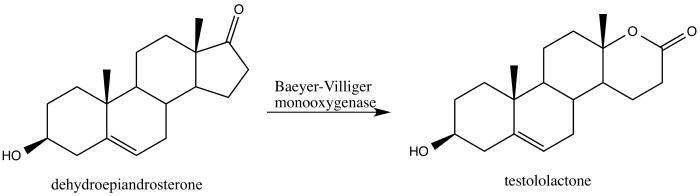 Виздор сообщил, что монооксигеназа Байера-Виллигера может превращать дегидроэпиандростерон в тестололактон
Виздор сообщил, что монооксигеназа Байера-Виллигера может превращать дегидроэпиандростерон в тестололактон