| Bacillus anthracis | |
|---|---|
 | |
| Микрофотография Bacillus anthracis (окраска спор фуксин-метиленовым синим) | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Firmicutes |
| Класс: | Бациллы |
| Порядок: | Bacillales |
| Семейство: | Bacillaceae |
| Род: | Bacillus |
| Виды: | B. anthracis |
| Биномиальное название | |
| Bacillus anthracis . Cohn 1872 | |
Bacillus anthracis является возбудителем сибирской язвы - распространенного заболевания домашнего скота, а иногда и человека - и только облигат патоген в пределах рода Bacillus. Это заболевание можно классифицировать как зооноз, в результате которого инфицированные животные передают болезнь человеку. B. anthracis - это грамположительная, образующая эндоспоры палочковидная бактерия шириной 1,0–1,2 мкм и длиной 3–5 мкм. Его можно выращивать в обычной питательной среде в аэробных или анаэробных условиях.
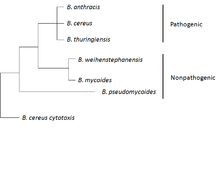 B. anthracis принадлежит к группе штаммов B. cereus.
B. anthracis принадлежит к группе штаммов B. cereus.  Структура B. anthracis
Структура B. anthracis Это одна из немногих бактерий, которые, как известно, синтезируют белковые капсулы (поли-D-гамма-глутаминовая кислота). Как и Bordetella pertussis, он образует кальмодулин -зависимую аденилатциклазу экзотоксин, известный как фактор отека сибирской язвы, вместе с смертельным исходом от сибирской язвы коэффициент. Он имеет близкое генотипическое и фенотипическое сходство с Bacillus cereus и Bacillus thuringiensis. Все три вида имеют общие клеточные размеры и морфологию. Все образуют овальные споры, расположенные в центре не набухшего спорангия. Эндоспоры B. anthracis, в частности, очень устойчивы, выдерживают экстремальные температуры, среду с низким содержанием питательных веществ и жесткую химическую обработку в течение десятилетий или столетий.
Эндоспора - это дегидратированная клетка с толстыми стенками и дополнительными слоями, которые образуются внутри клеточной мембраны. Он может оставаться бездействующим в течение многих лет, но если попадает в благоприятную среду, он снова начинает расти. Он изначально развивается внутри стержневой формы. Такие особенности, как расположение внутри стержня, размер и форма эндоспоры, а также то, вызывает ли это выпуклость стенки стержня или нет, характерны для определенных видов Bacillus. В зависимости от вида эндоспоры бывают круглыми, овальными или иногда цилиндрическими. Они очень рефрактильны и содержат дипиколиновую кислоту. Электронно-микроскопические снимки показывают, что у них тонкое внешнее покрытие эндоспор, толстое и внутреннее, окружающее содержимое эндоспор. Эндоспоры устойчивы к нагреванию, сушке и многим дезинфицирующим средствам (включая 95% этанол). Благодаря этим характеристикам эндоспоры B. anthracis чрезвычайно хорошо подходят для использования (в порошкообразной и аэрозольной форме) в качестве биологического оружия. Такое вооружение осуществлялось в прошлом по крайней мере пятью государственными программами создания биологического оружия - программами Соединенного Королевства, Японии, США, России. и Ирак - и было предпринято несколько других попыток.
B. anthracis - это палочковидные бактерии, длиной примерно от 3 до 5 мкм и шириной от 1 до 1,2 мкм. При выращивании в культуре они имеют тенденцию образовывать длинные цепочки бактерий. На чашках агар они образуют большие колонии в несколько миллиметров в поперечнике, как правило, белого или кремового цвета. Большинство штаммов B. anthracis образуют капсулу, которая придает колониям вид слизистой слизи.
B. anthracis имеет единственную хромосому, которая представляет собой кольцевую молекулу ДНК длиной 5 227 293 п.н. Он также имеет две кольцевые, внехромосомные, двухцепочечные плазмиды ДНК, pXO1 и pXO2. Обе плазмиды pXO1 и pXO2 необходимы для полной вирулентности и представляют два различных семейства плазмид.
| Характеристика | Хромосома | pXO1 | pXO2 |
|---|---|---|---|
| Размер (п.о.) | 5,227,293 | 181,677 | 94,829 |
| Количество генов | 5,508 | 217 | 113 |
| Кодирование репликона (%) | 84,3 | 77,1 | 76,2 |
| Средняя длина гена (нуклеотиды) | 800 | 645 | 639 |
| Содержание G + C (%) | 35,4 | 32,5 | 33,0 |
| рРНК опероны | 11 | 0 | 0 |
| тРНК | 95 | 0 | 0 |
| мРНК | 3 | 2 | 0 |
| фаги гены | 62 | 0 | 0 |
| транспозоны гены | 18 | 15 | 6 |
| Нарушенная рамка считывания | 37 | 5 | 7 |
| Гены с назначенной функцией | 2,762 | 65 | 38 |
| Консервативные гипотетические гены | 1,212 | 22 | 19 |
| Гены с неизвестной функцией | 657 | 8 | 5 |
| Гипотетические гены | 877 | 122 | 51 |
Плазмида pXO1 (182 kb) содержит гены, кодирующие компоненты токсина сибирской язвы : pag (защитный антиген, PA), lef (летальный фактор, LF) и cya (фактор отека, EF). Эти факторы содержатся в пределах острова патогенности размером 44,8 т.п.н. (PAI). Смертельный токсин представляет собой комбинацию PA с LF, а токсин отека представляет собой комбинацию PA с EF. PAI также содержит гены, которые кодируют активатор транскрипции AtxA и репрессор PagR, оба из которых регулируют экспрессию генов токсина сибирской язвы.
pXO2 кодирует пятигенный оперон (capBCADE), который синтезирует капсулу поли-γ-D-глутаминовой кислоты (полиглутамат). Эта капсула позволяет B. anthracis уклоняться от иммунной системы хозяина, защищая себя от фагоцитоза. Экспрессия оперона капсулы активируется регуляторами транскрипции AcpA и AcpB, расположенными на острове патогенности pXO2 (35 т.п.н.). Экспрессия AcpA и AcpB находится под контролем AtxA из pXO1.
89 известных штаммов B. anthracis включают:
Секвенирование всего генома сделало реконструкцию филогении B. anthracis чрезвычайно точной. Фактором, способствующим реконструкции, является то, что B. anthracis является мономорфным, то есть имеет низкое генетическое разнообразие, в том числе отсутствие какого-либо измеримого латерального переноса ДНК с момента его появления как вида. Отсутствие разнообразия происходит из-за короткой эволюционной истории, которая предотвратила мутационное насыщение в однонуклеотидных полиморфизмах.
Короткое время эволюции не обязательно означает короткое хронологическое время. При репликации ДНК возникают ошибки, которые превращаются в генетические мутации. Накопление этих мутаций с течением времени приводит к эволюции вида. Во время жизненного цикла B. anthracis он проводит значительное количество времени на стадии резервуара почвенных спор, на которой репликация ДНК не происходит. Эти продолжительные периоды покоя значительно снизили скорость эволюции организма.
B. anthracis принадлежит к группе B. cereus, состоящей из штаммов: B. cereus, B. anthracis, B. thuringiensis, B. weihenstephanensis, Б. mycoides и B. pseudomycoides. Первые три штамма являются патогенными или условно-патогенными для насекомых или млекопитающих, а последние три не считаются патогенными. Штаммы этой группы генетически и фенотипически гетерогенны в целом, но некоторые из штаммов более близки и филогенетически смешаны на уровне хромосом. Группа B. cereus обычно имеет сложные геномы и большинство из них несут различное количество плазмид.
B. cereus - это почвенная бактерия, которая может колонизировать кишечник беспозвоночных в качестве симбионта и является частой причиной пищевого отравления. Вырабатывает рвотный токсин, энтеротоксины и другие факторы вирулентности. Энтеротоксины и факторы вирулентности кодируются на хромосоме, тогда как рвотный токсин кодируется на плазмиде размером 270 т.п.н., pCER270.
B. thuringiensis является патогеном насекомых и характеризуется образованием параспоральных кристаллов инсектицидных токсинов Cry и Cyt. Гены, кодирующие эти белки, обычно расположены на плазмидах, которые могут быть потеряны из организма, что делает его неотличимым от B. cereus.
PlcR является глобальным регулятором транскрипции, который контролирует большую часть секретируемые факторы вирулентности B. cereus и B. thuringiensis. Он кодируется хромосомами и повсеместно встречается в клетке. Однако у B. anthracis ген plcR содержит единственное изменение основания в положении 640, бессмысленную мутацию, которая создает дисфункциональный белок. Хотя 1% группы B. cereus несет инактивированный ген plcR, ни один из них не несет специфической мутации, обнаруженной только у B. anthracis.
Ген plcR является частью двухгенного оперона с papR. Ген papR кодирует небольшой белок, который секретируется из клетки и повторно импортируется в виде процессированного гептапептида, образующего систему восприятия кворума. Отсутствие PlcR у B. anthracis является принципиальной характеристикой, отличающей его от других членов группы B. cereus. В то время как B. cereus и B. thuringiensis зависят от гена plcR для экспрессии их факторов вирулентности, B. anthracis полагается на плазмиды pXO1 и pXO2 для своей вирулентности. Bacillus cereus biovar anthracis, т.е. B. cereus с две плазмиды также способны вызывать сибирскую язву.
B. anthracis обладает антифагоцитарной капсулой, необходимой для полной вирулентности. Организм также производит три экзотоксина, кодируемых плазмидой: фактор отека, кальмодулин-зависимая аденилатциклаза, которая вызывает повышение внутриклеточного цАМФ и ответственна за тяжелый отек, обычно наблюдаемый при инфекциях B. anthracis, смертельный токсин, который вызывает некроз тканей, и защитный антиген, названный так из-за его использования в производстве защитных вакцин против сибирской язвы, который опосредует проникновение в клетки фактора отека и летального токсина.
Симптомы сибирской язвы зависят от типа инфекции и могут появиться в течение от 1 дня до более 2 месяцев. Все виды сибирской язвы, если их не лечить, могут распространяться по телу и вызывать тяжелые заболевания и даже смерть.
На основе их различают четыре формы сибирской язвы у человека.
Ряд вакцин против сибирской язвы был разработан для профилактического использования у домашнего скота и людей. Адсорбированная вакцина против сибирской язвы (AVA) может защитить от кожной и ингаляционной сибирской язвы. Однако эта вакцина используется только для взрослых из группы риска до контакта с сибирской язвой и не была одобрена для использования после контакта. Инфекции, вызванные B. anthracis, можно лечить с помощью β-лактама антибиотиков, таких как пенициллин, и других, которые активны против грамположительных бактерий. Резистентные к пенициллину B. anthracis можно лечить фторхинолонами, такими как ципрофлоксацин, или тетрациклиновыми антибиотиками, такими как доксициклин.
Компоненты чай, такой как полифенолы, обладают способностью значительно подавлять активность как B. anthracis, так и его токсина; споры, однако, не затрагиваются. Добавление молока в чай полностью подавляет его антибактериальную активность против сибирской язвы. Активность против B. anthracis в лаборатории не доказывает, что употребление чая влияет на течение инфекции, поскольку неизвестно, как эти полифенолы всасываются и распределяются в организме. B. anthracis можно культивировать на агаре PLET, селективной и дифференциальной среде, специально разработанной для селекции B. anthracis.
Достижения в методах генотипирования привели к усовершенствованию генетического анализа вариабельности и родства. Эти методы включают тандемный анализ множественных локусов с переменным числом (MLVA ) и системы типирования с использованием канонических однонуклеотидных полиморфизмов. Хромосома предка Эймса была секвенирована в 2003 году и способствует идентификации генов, участвующих в вирулентности B. anthracis. Недавно изолят B. anthracis H9401 был выделен от корейского пациента, страдающего желудочно-кишечной формой сибирской язвы. Цель Республики Корея - использовать этот штамм в качестве контрольного штамма для разработки рекомбинантной вакцины против сибирской язвы.
Штамм H9401, выделенный в Республике Корея, был секвенирован с использованием 454 GS. -FLX и проанализированы с использованием нескольких инструментов биоинформатики для выравнивания, аннотирования и сравнения H9401 с другими штаммами B. anthracis. Уровень охвата секвенированием предполагает молекулярное соотношение pXO1: pXO2: хромосома как 3: 2: 1, что идентично штаммам Ames Florida и Ames Ancestor. H9401 имеет 99,679% гомологии последовательности с Ames Ancestor с гомологией последовательности аминокислот 99,870%. H9401 имеет кольцевую хромосому (5218947 п.н. с 5480 предсказанными ORF ), плазмиду pXO1 (181 700 п.н. с 202 предсказанными ORF) и плазмиду pXO2 (94 824 п.н. с 110 предсказанными ORF). По сравнению с хромосомой Ames Ancestor выше, хромосома H9401 примерно на 8,5 kb меньше. Из-за высокой патогенности и сходства последовательностей с предком Эймса, H9401 будет использоваться в качестве эталона для тестирования эффективности вакцин против сибирской язвы в Республике Корея.
Поскольку геном B. anthracis был секвенирован, пытаются найти альтернативные способы борьбы с этим заболеванием. Бактерии разработали несколько стратегий, чтобы избежать распознавания иммунной системой. Преобладающий механизм избежания обнаружения, используемый всеми бактериями, - это молекулярный камуфляж. Незначительные изменения внешнего слоя, которые делают бактерии практически невидимыми для лизоцимов. Были идентифицированы и охарактеризованы три из этих модификаций. Они включают (1) N-гликозилирование N-ацетилмурамовой кислоты, (2) O-ацетилирование N-ацетилмурамовой кислоты и (3) N-деацетилирование N-ацетил-глюкозамина. Исследования последних нескольких лет были сосредоточены на предотвращении таких модификаций. В результате исследуется ферментативный механизм полисахариддеацетилаз, которые катализируют удаление ацетильной группы из N-ацетилглюкозамина и N-ацетилмурамовой кислоты, компонентов пептидогликанового слоя.
Как и большинство других патогенных бактерий, B. anthracis должна приобретать железо для роста и размножения в окружающей среде хозяина. Наиболее доступными источниками железа для патогенных бактерий являются группы гема, используемые хозяином для переноса кислорода. Для очистки гема от гемоглобина и миоглобина хозяина B. anthracis использует два секреторных сидерофорных белка, IsdX1 и IsdX2. Эти белки могут отделять гем от гемоглобина, позволяя поверхностным белкам B. anthracis транспортировать его в клетку.
Присутствие B. anthracis можно определить по образцам, взятым на не пористые поверхности.
 Play media
Play media Как отбирать пробы целлюлозной губкой на непористых поверхностях
 Play media
Play media Как отбирать пробы тампоном из макропены на непористых поверхностях
 Кристаллическая структура белка CapD B. anthracis
Кристаллическая структура белка CapD B. anthracis Французский врач Казимир Давайн (1812-1882) продемонстрировал, что симптомы сибирской язвы неизменно сопровождались микробом B. anthracis. За открытие приписывают немецкий врач Алоис Поллендер (1799–1879). B. anthracis была первой бактерией, которая убедительно продемонстрировала, что вызывает заболевание, Робертом Кохом в 1876 году. Название вида anthracis происходит от греческого сибирской язвы (ἄνθραξ), что означает «уголь» и относится к к наиболее распространенной форме заболевания, кожной сибирской язве, при которой образуются большие черные кожные поражения. На протяжении 19 века сибирская язва была инфекцией, которая повлекла за собой несколько очень важных медицинских разработок. Первой вакциной, содержащей живые организмы, была ветеринарная вакцина против сибирской язвы Луи Пастера.
Ссылки из SDH
1. Абакар, Махамат Х. и Хасан Х. Махамат. «Свойства и чувствительность к антибиотикам изолятов Bacillus Anthracis от людей, крупного рогатого скота и табанид, а также оценка табанида как механического переносчика сибирской язвы в Республике Чад». Иорданский журнал биологических наук, вып. 5, вып. 3, сентябрь 2012 г., стр. 203–208. EBSCOhost, search.ebscohost.com/login.aspx?direct=truedb=a9hAN=79730545site=ehost-livescope=site.
2. Эдмондс, Джейсон и др. «Множественное перекрестное заражение почты спорами Bacillus Anthracis». PLoS ONE, т. 11, вып. 4, апрель 2016 г., стр. 1–13. EBSCOhost, DOI: 10.1371 / journal.pone.0152225.
3. Сехавати, Мохаммад и др. «Внутреннее производство маркера размера ДНК из штамма Vaccinal Bacillus Anthracis». Иранский журнал микробиологии, вып. 7, вып. 1, февраль 2015 г., стр. 45–49. EBSCOhost, search.ebscohost.com/login.aspx?direct=truedb=a9hAN=103072230site=ehost-livescope=site.
4. Рой, П. и др. «Биохимическая и иммунологическая характеристика вакцины со спорами сибирской язвы у коз». Бангладешский журнал ветеринарной медицины, вып. 11, вып. 2, декабрь 2013 г., стр. 151–157. EBSCOhost, search.ebscohost.com/login.aspx?direct=truedb=a9hAN=96279450site=ehost-livescope=site.
5. Kušar, D., et al. «Обнаружение Bacillus Anthracis в воздухе, почве и тканях животных». Acta Veterinaria, vol. 62, нет. 1, январь 2012 г., стр. 77–89. EBSCOhost, DOI: 10.2298 / AVB1201077K.
| Викискладе есть медиафайлы, связанные с геномами Bacillus anthracis. |