 Стандартная искусственная ячейка (вверху) и искусственная ячейка доставки лекарств (внизу).
Стандартная искусственная ячейка (вверху) и искусственная ячейка доставки лекарств (внизу). Искусственная ячейка или минимальная клетка - это спроектированная частица, которая имитирует одну или несколько функций биологической клетки. Этот термин относится не к конкретному физическому объекту, а скорее к идее о том, что определенные функции или структуры биологических клеток могут быть заменены или дополнены синтетическим объектом. Часто искусственные клетки представляют собой биологические или полимерные мембраны, содержащие биологически активные материалы. Таким образом, наночастицы, липосомы, полимерсомы, микрокапсулы и ряд других частиц квалифицируются как искусственные клетки. Микроинкапсуляция обеспечивает метаболизм внутри мембраны, обмен небольшими молекулами и предотвращение прохождения через нее крупных веществ. Основные преимущества инкапсуляции включают улучшенную мимикрию в организме, повышенную растворимость груза и снижение иммунных ответов. Примечательно, что искусственные клетки оказались клинически успешными в гемоперфузии.
. В области синтетической биологии «живая» искусственная клетка была определена как полностью синтетическая клетка, которая может захватывать энергия, поддерживать ионные градиенты, содержать макромолекулы, а также хранить информацию и иметь возможность видоизменять. Такая клетка пока технически невозможна, но была создана разновидность искусственной клетки, в которой полностью синтетический геном был введен в опорожненные геномом клетки-хозяева. Хотя это и не является полностью искусственным, поскольку цитоплазматические компоненты, а также мембрана клетки-хозяина сохраняются, сконструированная клетка находится под контролем синтетического генома и способна реплицироваться.
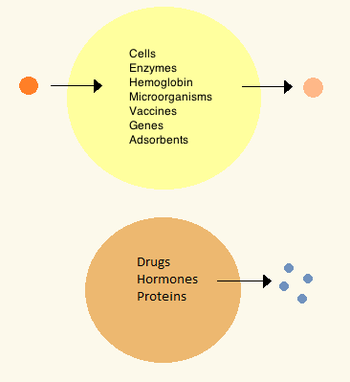
Были разработаны первые искусственные клетки d Томасом Чангом в Университете Макгилла в 1960-х. Эти клетки состояли из ультратонких мембран из нейлона, коллодия или сшитого белка, полупроницаемые свойства которых позволяли диффузию небольших молекул внутри и из клетки. Эти клетки имели микронный размер и содержали клетки, ферменты, гемоглобин, магнитные материалы, адсорбенты и белки.
. Позднее искусственные клетки имели размеры от сотен микрометров до нанометров и могут нести микроорганизмы, вакцины, гены, лекарства, гормоны и пептиды. Первое клиническое использование искусственных клеток было в гемоперфузии путем инкапсуляции активированного угля.
. В 1970-х годах исследователи смогли ввести ферменты, белки и гормоны в биоразлагаемые микрокапсулы, что позже привело к клиническим исследованиям. использование при таких заболеваниях, как синдром Леша – Найхана. Хотя первоначальные исследования Чанга были сосредоточены на искусственных эритроцитах, только в середине 1990-х годов были разработаны биоразлагаемые искусственные эритроциты. Искусственные клетки для биологической инкапсуляции клеток были впервые использованы в клинике в 1994 году для лечения пациентов с диабетом, и с тех пор другие типы клеток, такие как гепатоциты, взрослые стволовые клетки и генно-инженерные клетки были инкапсулированы и изучаются для использования в регенерации тканей.
29 декабря 2011 года химики из Гарвардского университета сообщили о создании искусственной клеточной мембраны.
. 2014 г. были произведены самовоспроизводящиеся синтетические бактериальные клетки с клеточными стенками и синтетической ДНК. В январе того же года исследователи создали искусственную эукариотическую клетку, способную проводить множество химических реакций посредством рабочих органелл.
. В сентябре 2018 года исследователи из Калифорнийского университета разработали искусственные клетки, которые могут убивать бактерии. Клетки создавались снизу вверх - как блоки Lego - для уничтожения бактерий.
 Типичные типы искусственных клеточных мембран.
Типичные типы искусственных клеточных мембран. Мембраны для искусственных клеток должны быть сделаны из простых полимеров, сшитые белки, липидные мембраны или полимер-липидные комплексы. Кроме того, мембраны могут быть сконструированы для представления поверхностных белков, таких как альбумин, антигенов, носителей Na / K-АТФазы, или пор, таких как как ионные каналы. Обычно используемые материалы для производства мембран включают полимеры гидрогеля, такие как альгинат, целлюлоза и термопластичные полимеры, такие как гидроксиэтилметакрилат-метилметакрилат (HEMA-MMA), полиакрилонитрил-поливинилхлорид (ПАН-ПВХ), а также варианты вышеперечисленных. Используемый материал определяет проницаемость клеточной мембраны, которая для полимера зависит от отсекаемой молекулярной массы (MWCO). MWCO - это максимальная молекулярная масса молекулы, которая может свободно проходить через поры, и важна для определения адекватной диффузии питательных веществ, отходов и других критических молекул. Гидрофильные полимеры потенциально биосовместимы и могут быть изготовлены в различных формах, которые включают полимерные мицеллы, золь-гель смеси, физические смеси и сшитые частицы. и наночастицы. Особый интерес представляют реагирующие на раздражители полимеры, которые реагируют на pH или изменения температуры для использования в целевой доставке. Эти полимеры можно вводить в жидкой форме посредством макроскопической инъекции и затвердевать или загустевать in situ из-за разницы в pH или температуре. Препараты наночастиц и липосом также обычно используются для инкапсуляции и доставки материала. Основным преимуществом липосом является их способность сливать с мембранами клеток и органелл.
Было разработано множество вариантов приготовления и инкапсулирования искусственных клеток. Обычно синтезируются везикулы, такие как наночастица, полимерсома или липосома. Эмульсию обычно получают с использованием оборудования высокого давления, такого как гомогенизатор высокого давления или a. Два способа микрокапсулирования нитроцеллюлозы также описаны ниже.
В гомогенизаторе высокого давления две жидкости в суспензии масло / жидкость проталкиваются через небольшое отверстие под очень высоким давлением. Этот процесс разделяет продукты и позволяет создавать очень мелкие частицы размером всего 1 нм.
В этом методе используется запатентованный микрофлюидизатор для получения большего количества гомогенных суспензий, которые могут создавать более мелкие частицы, чем гомогенизаторы. Сначала используется гомогенизатор для создания грубой суспензии, которая затем закачивается в микрофлюидизатор под высоким давлением. Затем поток разделяется на два потока, которые будут реагировать с очень высокими скоростями в камере взаимодействия, пока не будет получен желаемый размер частиц. Этот метод позволяет производить в больших масштабах фосфолипидные липосомы и последующие нанокапсулы материалов.
В этом методе раствор клеток добавляют по каплям в раствор нитрата целлюлозы коллодий. Когда капля проходит через коллодий, она покрывается мембраной благодаря свойствам межфазной полимеризации коллодия. Позже клетка оседает в парафине, где мембрана застывает, и, наконец, суспендируется в физиологическом растворе. Капельный метод используется для создания больших искусственных клеток, содержащих биологические клетки, стволовые клетки и генно-инженерные стволовые клетки.
Метод эмульсии отличается тем, что материал, который нужно инкапсулировать, обычно меньше по размеру и помещается на дно реакционной камеры, куда добавляется коллодий. сверху и центрифугировать, или иным образом перемешивать для создания эмульсии. Затем инкапсулированный материал диспергируют и суспендируют в физиологическом растворе.
Искусственные клетки, используемые для доставки лекарств, отличаются от других искусственных клеток, поскольку их содержимое предназначено для диффузии из мембраны, или быть поглощенными и переваренными клеткой-мишенью-хозяином. Часто используются субмикронные искусственные клетки с липидной мембраной, которые можно обозначать как нанокапсулы, наночастицы, полимерсомы или другие варианты этого термина.
Ферментная терапия активно изучается для генетических метаболических заболеваний, когда фермент чрезмерно экспрессируется, недостаточно экспрессируется, дефектен или отсутствует вовсе. В случае недостаточной экспрессии или экспрессии дефектного фермента, активная форма фермента вводится в организм для компенсации дефицита. С другой стороны, ферментативной сверхэкспрессии можно противодействовать введением конкурирующего нефункционального фермента; то есть фермент, который метаболизирует субстрат до неактивных продуктов. При помещении в искусственную клетку ферменты могут выполнять свои функции в течение гораздо более длительного периода по сравнению со свободными ферментами и могут быть дополнительно оптимизированы конъюгацией полимеров.
Первым ферментом, изученным при искусственной инкапсуляции клеток, была аспарагиназа. для лечения лимфосаркомы у мышей. Это лечение задержало начало и рост опухоли . Эти первоначальные результаты привели к дальнейшим исследованиям использования искусственных клеток для доставки ферментов в тирозин зависимых меланомах. Эти опухоли в большей степени зависят от тирозина, чем нормальные клетки для роста, и исследования показали, что снижение системных уровней тирозина у мышей может подавлять рост меланом. Использование искусственных клеток для доставки тирозиназы ; и фермент, который переваривает тирозин, обеспечивает лучшую стабильность фермента и доказал свою эффективность в удалении тирозина без серьезных побочных эффектов, связанных с деправацией тирозина из рациона.
Терапия искусственными клеточными ферментами также представляет интерес для активация пролекарств, таких как ифосфамид, при некоторых видах рака. Искусственные клетки, инкапсулирующие фермент цитохром p450, который превращает это пролекарство в активное лекарство, могут быть адаптированы для накопления в карциноме поджелудочной железы или имплантации искусственных клеток близко к месту опухоли. Здесь локальная концентрация активированного ифосфамида будет намного выше, чем в остальной части тела, что предотвратит системную токсичность. Лечение было успешным на животных и показало удвоение медианы выживаемости среди пациентов с запущенной стадией рака поджелудочной железы в клинических испытаниях фазы I / II, а также утроение показателя выживаемости в течение одного года.
При лечении генетических заболеваний генная терапия направлена на вставку, изменение или удаление генов в клетках пораженного человека. Технология в значительной степени опирается на вирусные векторы, что вызывает опасения по поводу инсерционного мутагенеза и системного иммунного ответа, которые привели к смерти людей и развитию лейкемии в клинических испытаниях. Обход потребности в векторах за счет использования голой или плазмидной ДНК в качестве собственной системы доставки также сталкивается с такими проблемами, как низкая эффективность трансдукции и плохое нацеливание на ткани при системном введении.
Искусственные клетки были предложены в качестве невирусный вектор, с помощью которого инкапсулируются и имплантируются генетически модифицированные неавтологичные клетки для доставки рекомбинантных белков in vivo. Эффективность этого типа иммуноизоляции была доказана на мышах путем доставки искусственных клеток, содержащих мышиный гормон роста, которые устраняли задержку роста у мутантных мышей. Несколько стратегий прошли до клинических испытаний на людях для лечения рака поджелудочной железы, бокового склероза и контроля боли.
Первое клиническое использование искусственных клеток было в гемоперфузия путем инкапсуляции активированного угля. Активированный уголь обладает способностью адсорбировать множество крупных молекул и долгое время был известен своей способностью удалять токсичные вещества из крови при случайном отравлении или передозировке. Однако перфузия путем прямого введения угля токсична, поскольку приводит к эмболиям и повреждению клеток крови с последующим удалением тромбоцитами. Искусственные клетки позволяют токсинам проникать в клетку, удерживая опасный груз внутри своей ультратонкой мембраны.
Искусственная клетка гемоперфузия была предложена как менее дорогостоящий и более эффективный способ детоксикации, чем гемодиализ, при котором фильтрация крови происходит только путем разделения по размеру физической мембраной. При гемоперфузии тысячи адсорбирующих искусственных клеток удерживаются внутри небольшого контейнера за счет использования двух экранов на каждом конце, через которые кровь пациента перфузирует. По мере циркуляции крови токсины или лекарства диффундируют в клетки и задерживаются абсорбирующим материалом. Мембраны искусственных клеток намного тоньше тех, что используются при диализе, и их небольшой размер означает, что они имеют большую площадь поверхности мембраны . Это означает, что часть клетки может иметь теоретический массоперенос, который в сто раз выше, чем у целого аппарата искусственной почки. Устройство было разработано как рутинный клинический метод для пациентов, получающих лечение от случайного или суицидального отравления, но также использовалось в качестве терапии при печеночной недостаточности и почечной недостаточности, выполняя часть функции. этих органов. Гемоперфузия искусственных клеток также была предложена для использования в иммуноадсорбции, посредством которой антитела могут быть удалены из организма путем прикрепления иммуноадсорбирующего материала, такого как альбумин, на поверхности искусственных клеток. Этот принцип использовался для удаления антител группы крови из плазмы при трансплантации костного мозга и для лечения гиперхолестеринемии через моноклональные антитела для удаления низкоплотных липопротеины. Гемоперфузия особенно полезна в странах со слабой производственной отраслью гемодиализа, поскольку устройства, как правило, там дешевле и используются у почечной недостаточности пациентов.
 Схематическое изображение инкапсулированных клеток внутри искусственной мембраны.
Схематическое изображение инкапсулированных клеток внутри искусственной мембраны. Наиболее распространенным методом приготовления искусственных клеток является инкапсуляция клеток. Инкапсулированные клетки обычно достигаются путем образования капель контролируемого размера из жидкой клеточной суспензии, которые затем быстро затвердевают или желатинизируются для обеспечения дополнительной стабильности. Стабилизация может быть достигнута за счет изменения температуры или за счет сшивания материала. Микросреда, которую видит клетка, изменяется после инкапсуляции. Обычно он переходит от монослоя к суспензии в полимерном каркасе внутри полимерной мембраны. Недостатком метода является то, что инкапсуляция клетки снижает ее жизнеспособность и способность к пролиферации и дифференцировке. Кроме того, через некоторое время внутри микрокапсулы клетки образуют кластеры, которые ингибируют обмен кислорода и метаболические отходы, что приводит к апоптозу и некрозу, таким образом ограничивая эффективность клеток и активируя организм хозяина. иммунная система. Искусственные клетки оказались успешными для трансплантации ряда клеток, включая островков Лангерганса для лечения диабета, клеток паращитовидной железы и клеток коры надпочечников.
Нехватка доноров органов делает искусственные клетки ключевыми фигурами в альтернативных методах лечения печеночной недостаточности. Использование искусственных клеток для трансплантации гепатоцитов продемонстрировало осуществимость и эффективность в обеспечении функции печени на моделях заболеваний печени животных и биоискусственных устройствах для печени. Исследования основывались на экспериментах, в которых гепатоциты были прикреплены к поверхности микроносителей и превратились в гепатоциты, которые инкапсулированы в трехмерную матрицу в микрокаплях альгината, покрытых внешней кожей полилизин. Ключевым преимуществом этого способа доставки является отказ от иммуносупрессивной терапии на время лечения. Инкапсуляции гепатоцитов были предложены для использования в биоартификационной печени. Устройство состоит из цилиндрической камеры, заполненной изолированными гепатоцитами, через которую плазма пациента циркулирует экстракорпорально по типу гемоперфузии. Поскольку микрокапсулы имеют высокое отношение площади поверхности к объему, они обеспечивают большую поверхность для диффузии субстрата и могут вмещать большое количество гепатоцитов. Лечение мышей с индуцированной печеночной недостаточностью показало значительное увеличение выживаемости. Системы искусственной печени все еще находятся на ранней стадии разработки, но демонстрируют потенциал для пациентов, ожидающих трансплантации органов или пока собственная печень пациента регенерируется в достаточной степени для восстановления нормальной функции. На данный момент клинические испытания с использованием систем искусственной печени и трансплантации гепатоцитов при терминальной стадии заболеваний печени показали улучшение показателей здоровья, но еще не улучшили выживаемость. Кратковременный срок жизни и агрегация искусственных гепатоцитов после трансплантации - главные препятствия, с которыми можно столкнуться. Гепатоциты, совместно инкапсулированные с стволовыми клетками, демонстрируют большую жизнеспособность в культуре, и после имплантации и имплантации только искусственных стволовых клеток также наблюдается регенерация печени. Поскольку такой интерес возник к использованию стволовых клеток для инкапсуляции в регенеративной медицине.
Было предложено пероральное употребление живых бактериальных клеток колоний, и это в настоящее время проходит терапию для модуляции кишечной микрофлоры , профилактики диарейных заболеваний, лечения H. Pylori инфекции, атопические воспаления, непереносимость лактозы и иммунная модуляция, среди прочего. Предлагаемый механизм действия полностью не изучен, но предполагается, что он имеет два основных эффекта. Первый - это эффект питания, при котором бактерии конкурируют с бактериями, продуцирующими токсины. Второй - санитарный эффект, который стимулирует устойчивость к колонизации и стимулирует иммунный ответ. Оральная доставка бактериальных культур часто является проблемой, потому что они нацелены на иммунную систему и часто разрушаются при пероральном приеме. Искусственные клетки помогают решить эти проблемы, обеспечивая имитацию в организме и избирательное или долгосрочное высвобождение, тем самым увеличивая жизнеспособность бактерий, достигающих желудочно-кишечной системы. Кроме того, инкапсуляция живых бактериальных клеток может быть разработана для обеспечения диффузии небольших молекул, включая пептиды, в организм в терапевтических целях. Мембраны, которые оказались успешными для доставки бактерий, включают ацетат целлюлозы и варианты альгината. Дополнительные области применения, которые связаны с инкапсуляцией бактериальных клеток, включают защиту от заражения M. Туберкулез и активация иммунной системы секретирующих Ig клеток. Технология ограничена риском системных инфекций, неблагоприятной метаболической активностью и риском переноса генов. Однако более сложной задачей остается доставка достаточного количества жизнеспособных бактерий к интересующему участку.
Наноразмерные переносчики кислорода используются как тип заменителей эритроцитов , хотя в них отсутствуют другие компоненты эритроцитов. Они состоят из синтетической полимерсомы или искусственной мембраны, окружающей очищенный гемоглобин животного, человека или рекомбинантный гемоглобин. В целом, доставка гемоглобина по-прежнему является проблемой, поскольку он очень токсичен, если доставляется без каких-либо модификаций. В некоторых клинических испытаниях наблюдались вазопрессорные эффекты.
Исследовательский интерес к использованию искусственных клеток для крови возник после страха перед СПИДом 1980-х годов.. Помимо исключения возможности передачи заболевания, желательны искусственные эритроциты, поскольку они устраняют недостатки, связанные с переливанием аллогенной крови, такие как определение группы крови, иммунные реакции и короткий срок хранения, составляющий 42 дня. Заменитель гемоглобина можно хранить при комнатной температуре и не в холодильнике более года. Были предприняты попытки разработать полноценный рабочий эритроцит, который содержит углекислый газ не только как переносчик кислорода, но также и ферменты, связанные с клеткой. Первая попытка была предпринята в 1957 г. путем замены мембраны эритроцитов ультратонкой полимерной мембраной, за которой последовала инкапсуляция через липидную мембрану, а в последнее время - биоразлагаемую полимерную мембрану. Биологическая мембрана эритроцитов, включающая липиды и связанные белки, также может быть использована для инкапсуляции наночастиц и увеличения времени пребывания in vivo путем обхода поглощения макрофагами и системного клиренса.
Лейкополимерсома - это полимерсома, сконструированная так, чтобы обладать адгезионными свойствами лейкоцитов. Полимерсомы представляют собой везикулы, состоящие из двухслойного листа, который может инкапсулировать многие активные молекулы, такие как лекарства или ферменты. Добавляя адгезивные свойства лейкоцитов к их мембранам, они могут замедляться или катиться вдоль эпителиальных стенок в быстро текущей кровеносной системе.
Немецкий патолог Рудольф Вирхов выдвинул идею, что не только жизнь возникает из клеток, но и каждая клетка происходит из другой клетки; «Omnis cellula e cellula». До сих пор большинство попыток создать искусственную ячейку создавали только пакет, который может имитировать определенные задачи ячейки. Достижения в реакциях бесклеточной транскрипции и трансляции позволяют экспрессировать многие гены, но эти усилия далеки от создания полностью работоспособной клетки.
Будущее за созданием протоклетки, или клетки, которая имеет все минимальные требования для жизни. Члены J. Институт Крейга Вентера использовал вычислительный подход сверху вниз для исключения генов в живом организме до минимального набора генов. В 2010 году команде удалось создать реплицирующийся штамм Mycoplasma mycoides (Mycoplasma labratorium ) с использованием синтетически созданной ДНК, которая считается минимальным требованием для жизни, которая была вставлена в генетически пустую бактерию.. Есть надежда, что процесс нисходящего биосинтеза позволит внедрить новые гены, которые будут выполнять полезные функции, такие как генерация водорода для топлива или улавливание избыточного диоксида углерода в атмосфере. мириады регуляторных, метаболических и сигнальных сетей полностью не охарактеризованы. Эти нисходящие подходы имеют ограничения для понимания фундаментальной молекулярной регуляции, поскольку организмы-хозяева имеют сложный и не полностью определенный молекулярный состав. В 2019 году была опубликована полная вычислительная модель всех путей в клетке Mycoplasma Syn3.0, представляющая первую полную in silico модель для живого минимального организма.
A восходящий подход к построению искусственная клетка будет включать создание протоклетки de novo полностью из неживых материалов. Предлагается создать везикулу из бислоя фосфолипидов с ДНК, способную к самовоспроизведению, с использованием синтетической генетической информации. Три основных элемента таких искусственных клеток - это образование липидной мембраны, ДНК и РНК, репликация посредством матричного процесса и сбор химической энергии для активный транспорт через мембрану. Основными препятствиями, которые предвидятся и встречаются с этой предлагаемой протоклеткой, являются создание минимальной синтетической ДНК, которая содержит всю информацию, достаточную для жизни, и воспроизведение негенетических компонентов, которые являются неотъемлемой частью развития клеток, таких как молекулярная самоорганизация. Однако есть надежда, что такой подход «снизу вверх» поможет понять фундаментальные вопросы организации на клеточном уровне и происхождения биологической жизни. До сих пор ни одна полностью искусственная клетка, способная к самовоспроизведению, не была синтезирована с использованием молекул жизни, и эта цель все еще находится в далеком будущем, хотя различные группы в настоящее время работают над этой целью.
Другой метод, предложенный для Создание протоклетки более похоже на условия, которые, как полагают, присутствовали во время эволюции, известные как изначальный суп. Различные полимеры РНК могут быть инкапсулированы в везикулы, и в таких небольших граничных условиях будут проверены химические реакции.
Крупные компании, такие как ExxonMobil, которые имеют сотрудничает с Synthetic Genomics Inc ; Собственная биосинтетическая компания Крейга Вентера в разработке топлива из водорослей.
По состоянию на 2016 год Mycoplasma genitalium - единственный организм, используемый в качестве отправной точки для создания минимальной клетки, поскольку он имеет наименьший из известных геномов, который можно культивировать в лабораторных условиях; разновидность дикого типа насчитывает 482, и удаление ровно 100 генов, считающихся несущественными, привело к жизнеспособному штамму с улучшенной скоростью роста. Сокращенный геном Escherichia coli считается более полезным, и были разработаны жизнеспособные штаммы с удалением 15% генома.
Концепция электронной Искусственная клетка была расширена серией из 3 проектов ЕС, координируемых Джоном Маккаскиллом с 2004 по 2015 год.
Европейская комиссия спонсировала разработку программы программируемой искусственной эволюции клеток (PACE) с 2004 по 2008 г., целью которой было заложить основу для создания «микроскопических самоорганизующихся, самоорганизующихся». - воспроизводящие и эволюционирующие автономные объекты, построенные из простых органических и неорганических веществ, которые могут быть генетически запрограммированы для выполнения определенных функций "для возможной интеграции в информационные системы. В рамках проекта PACE была разработана первая Omega Machine, микрофлюидная система жизнеобеспечения для искусственных клеток, которая могла бы дополнять химически недостающие функциональные возможности (как первоначально предложили Норман Паккард, Стин Расмуссен, Марк Бидо и Джон Маккаскилл). Конечная цель состояла в том, чтобы получить эволюционирующую гибридную клетку в сложной микромасштабной программируемой среде. Затем функции Омега-машины можно было поэтапно удалить, что поставило ряд решаемых проблем эволюции для искусственной клеточной химии. В рамках проекта была достигнута химическая интеграция до уровня пар трех основных функций искусственных клеток (генетическая подсистема, система сдерживания и метаболическая система) и созданы новые программируемые микрожидкостные среды с пространственным разрешением для интеграции сдерживания и генетической амплификации. Проект привел к созданию Европейского центра живых технологий.
После этого исследования, в 2007 году, Джон Маккаскилл предложил сконцентрироваться на электронно-дополненной искусственной ячейке, названной электронной химической ячейкой. Ключевая идея заключалась в том, чтобы использовать массивно-параллельный массив электродов, соединенных с локально выделенными электронными схемами, в двумерной тонкой пленке, чтобы дополнить появляющиеся химические сотовые функции. Локальная электронная информация, определяющая схемы переключения электродов и считывания, может служить электронным геномом, дополняя молекулярную последовательную информацию в появляющихся протоколах. Предложение по исследованию было успешным с Европейской комиссией, и международная группа ученых, частично совпадающая с консорциумом PACE, приступила к работе в 2008-2012 гг. Над проектом Electronic Chemical Cells. Проект продемонстрировал, среди прочего, что локальный перенос определенных последовательностей с электронным управлением может быть использован в качестве искусственной системы пространственного контроля для генетической пролиферации будущих искусственных клеток, и что основные процессы метаболизма могут осуществляться с помощью электродов с соответствующим покрытием.
Основным ограничением этого подхода, помимо первоначальных трудностей в освоении микромасштабной электрохимии и электрокинетики, является то, что электронная система взаимосвязана как жесткая неавтономная часть макроскопического оборудования. В 2011 году Маккаскилл предложил перевернуть геометрию электроники и химии: вместо того, чтобы помещать химические вещества в активную электронную среду, поместить микроскопическую автономную электронику в химическую среду. Он организовал проект, посвященный третьему поколению электронных искусственных ячеек в масштабе 100 мкм, которые могли бы самостоятельно собираться из двух полуэлементных «пластинок», чтобы заключить внутреннее химическое пространство, и функционировать с помощью активной электроники, питаемой от среды. они погружены внутрь. Такие клетки могут копировать как свое электронное, так и химическое содержимое, и будут способны к эволюции в пределах ограничений, обеспечиваемых их специальными заранее синтезированными микроскопическими строительными блоками. В сентябре 2012 года работа над этим проектом началась.
Исследование Protocell вызвало разногласия и противоположные мнения, включая критику расплывчатого определения «искусственной жизни». Создание базовой единицы жизни является наиболее насущной этической проблемой, хотя наиболее распространенным беспокойством по поводу протоклеток является их потенциальная угроза здоровью человека и окружающей среде из-за неконтролируемой репликации.
В середине 2010-х исследовательское сообщество начало осознавать необходимость объединения области исследований синтетических клеток, признавая, что задача создания целого живого организма из неживых компонентов выходит за рамки ресурсов одной страны.
В 2017 году было начато международное крупномасштабное исследовательское сотрудничество по созданию синтетической живой клетки, за которым последовали национальные организации по синтетическим клеткам в нескольких странах. Эти национальные организации включают FabriCell, MaxSynBio и BaSyC. Европейские усилия по синтетическим клеткам были объединены в 2019 году в рамках инициативы SynCellEU.