 | |
| Имена | |
|---|---|
| Другие названия Оксид мышьяка (V). Оксид мышьяка. Арсен ic ангидрид | |
| Идентификаторы | |
| Номер CAS | |
| 3D-модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.013.743 |
| Номер EC |
|
| PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1559 |
| Панель управления CompTox (EPA ) | |
InChI
| |
SMILES
| |
| Свойства | |
| Химическая формула | As2O5 |
| Молярная масса | 229,8402 г / моль |
| Внешний вид | белый гигроскопичный порошок |
| Плотность | 4,32 г / см |
| Температура плавления | 315 ° C (599 ° F; 588 K) (разлагается) |
| Растворимость в воде | 59,5 г / 100 мл (0 ° C). 65,8 г / 100 мл (20 ° C). 8,20 г / 100 мл (100 ° C)) |
| Растворимость | растворим в спирте |
| Кислотность (pK a) | 7 |
| Опасности | |
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H301, H331, H350, H400, H410 |
| Меры предосторожности GHS | P201, P202, P261, P264, P270, P271, P273, P281, P301 + 310, P304 + 340, P308 + 313, P311, P321, P330, P391, P403 + 233, P405, P501 |
| NFPA 704 ( огненный алмаз) |  0 4 0 0 4 0 |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 8 мг / кг (крыса, перорально) |
| НИОШ (пределы воздействия на здоровье в США): | |
| PEL (допустимый) | [1910.1018] TWA 0,010 мг / м |
| REL (рекомендуется) | Ca C 0,002 мг / м [15 минут] |
| IDLH (Непосредственная опасность) | Ca [5 мг / м (As)] |
| Родственные соединения | |
| Другие катионы | Пятиокись фосфора. Пятиокись сурьмы |
| Родственные соединения | Триоксид мышьяка. Мышьяковая кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в информационном окне | |
Пятиокись мышьяка - это неорганическое соединение с формулой As 2O5. Это стекловидное, белое, расплывающееся твердое вещество относительно нестабильно, что соответствует редкости степени окисления As (V). Более распространенным и гораздо более важным с коммерческой точки зрения является оксид мышьяка (III) (As 2O3). Все соединения мышьяка высокотоксичны и поэтому находят лишь ограниченное коммерческое применение.
Структура состоит из тетраэдрических {AsO 4 } и октаэдрических {AsO 6 } центров, соединенных общими углами. Структура отличается от соответствующей оксида фосфора (V) ; в результате, хотя твердый раствор с этим оксидом все еще существует, он прогрессирует только до эквимолярной точки, когда фосфор замещает мышьяк во всех своих тетраэдрических участках. Аналогичным образом, пятиокись мышьяка может также растворять до эквимолярного количества пятиокиси сурьмы, поскольку сурьма заменяет мышьяк только в его октаэдрических участках.
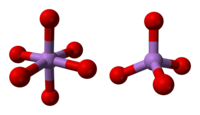 |  | 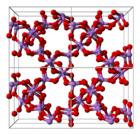 |
Парацельс Маккер обнаружил кристаллизующуюся соль, которую он назвал «самонейтральным мышьяком». Эта соль была остатком, полученным после отгонки азотной кислоты из смеси нитрата калия и триоксида мышьяка. Раньше Парацельс подогревал смесь триоксида мышьяка и нитрата калия. Он применил термин «мышьяк fixum ’к продукту. А. Либавиус назвал тот же продукт «butyrum arsenici» (масло мышьяка), хотя этот термин фактически использовался для трихлорида мышьяка. Все продукты, обнаруженные Парацельсом и Либавиусом, были нечистыми арсенатами щелочных металлов. Шееле получил ряд арсенатов действием мышьяковой кислоты на щелочи. Одним из арсенатов, которые он приготовил, был пятиокись мышьяка. Вода в щелочах испарялась при 180 ° C, и пятиокись мышьяка была стабильной ниже 400 ° C.
Пентоксид мышьяка можно кристаллизовать путем нагревания As 2O3в атмосфере кислорода. Эта реакция обратима:
Сильные окислители, такие как озон, пероксид водорода и азотная кислота превращает триоксид мышьяка в пятиокись.
Мышьяковая кислота может быть получена путем обычной обработки соединений мышьяка, включая окисление мышьяка и содержащих мышьяк минералов на воздухе. Примером является обжиг orpiment, типичной сульфидной мышьяковой руды:
Как и все соединения мышьяка, пентоксид очень токсичен. Его восстановленное производное арсенит, которое представляет собой соединение As (III), еще более токсично, поскольку оно имеет высокое сродство к тиольным группам остатков цистеина в белках.
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как определено в разделе 302 США Закона США о чрезвычайном планировании и праве на информацию (42 USC 11002) и подчиняется строгим требованиям отчетности предприятий, которые производят, хранят или используют его в значительных количествах.
| journal =()