 В атомном орбитальных волновых в атоме водорода. Главное квантовое число ( n) находится справа от каждой строки, а азимутальное квантовое число ( ℓ) обозначается буквой вверху каждого столбца.
В атомном орбитальных волновых в атоме водорода. Главное квантовое число ( n) находится справа от каждой строки, а азимутальное квантовое число ( ℓ) обозначается буквой вверху каждого столбца. | Часть цикла статей о |
| Квантовая механика |
|---|
| Уравнение Шредингера |
| Фон |
| Основы |
| Эксперименты |
| Составы |
| Уравнения |
| Интерпретации |
| Дополнительные темы |
Ученые
|
|
Азимутальные квантовое число является квантовым числом для атомной орбитали, который определяет его орбитальный угловой момент и описывает форму орбиты. Азимутальные квантовое число является вторым из набора квантовых чисел, описывающих уникальное квантовое состояние электрона (остальные являясь главным квантовым числом, то магнитное квантовое число, а спиновое квантовое число ). Он также известен как квантовое число орбитального углового момента, орбитальное квантовое число или второе квантовое число и обозначается как ℓ (произносится как ell).
С энергетическими состояниями электронов атома связаны четыре квантовых числа: n, ℓ, m ℓ и m s. Они определяют полное уникальное квантовое состояние отдельного электрона в атоме и составляют его волновую функцию или орбиталь. При решении для получения волновой функции уравнение Шредингера сводится к трем уравнениям, которые приводят к первым трем квантовым числам. Следовательно, все уравнения для первых трех квантовых чисел взаимосвязаны. Азимутальное квантовое число возникло в результате решения полярной части волнового уравнения, как показано ниже, в зависимости от сферической системы координат, которая обычно лучше всего работает с моделями, имеющими некоторый проблеск сферической симметрии.
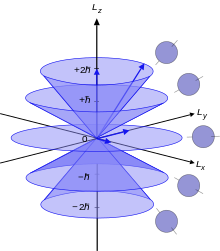 Иллюстрация квантово-механического орбитального углового момента.
Иллюстрация квантово-механического орбитального углового момента. Атомный электрон углового момента, L, связан с его квантовым числом л по следующему уравнению:
где ħ - приведенная постоянная Планка, L 2 - оператор орбитального углового момента и - волновая функция электрона. Квантовое число ℓ всегда является неотрицательным целым числом: 0, 1, 2, 3 и т. Д. L не имеет реального значения, кроме его использования в качестве оператора углового момента. При упоминании углового момента, то лучше просто использовать квантовое число л.
Атомные орбитали имеют отличительную форму, обозначенную буквами. На иллюстрации буквы s, p и d ( соглашение, пришедшее из спектроскопии ) описывают форму атомной орбитали.
Их волновые функции принимают форму сферических гармоник и описываются полиномами Лежандра. Различные орбитали, относящиеся к разным значениям ℓ, иногда называют суб-оболочками и обозначаются строчными латинскими буквами (выбранными по историческим причинам) следующим образом:
| Азимутальное число ( ℓ) | Историческое письмо | Максимум электронов | Историческое название | Форма |
|---|---|---|---|---|
| 0 | s | 2 | s арфы | сферический |
| 1 | п | 6 | р rincipal | три полярных орбитали в форме гантелей ; по одному лепестку на каждом полюсе осей x, y и z (оси + и -) |
| 2 | d | 10 | d iffuse | девять гантелей и один бублик (или «уникальная форма №1», см. это изображение сферических гармоник, в центре третьего ряда ) |
| 3 | ж | 14 | е undamental | «Уникальная форма № 2» (см. Это изображение сферических гармоник, в центре нижнего ряда ) |
| 4 | грамм | 18 | ||
| 5 | час | 22 | ||
| 6 | я | 26 | ||
| Буквы после субоболочки f следуют только за буквой f в алфавитном порядке, за исключением буквы j и уже использованных. | ||||
Каждое из состояний с различным угловым моментом может принимать 2 (2 ℓ + 1) электрона. Это связано с тем, что третье квантовое число m ℓ (которое можно условно представить как квантованную проекцию вектора углового момента на ось z) изменяется от - ℓ до ℓ в целых единицах, и поэтому существует 2 ℓ + 1 возможных состояния. Каждая отдельная орбиталь n, ℓ, m ℓ может быть занята двумя электронами с противоположными спинами (заданными квантовым числом m s = ± ½), что дает 2 (2 ℓ + 1) электрона в целом. Орбитали с более высоким л, чем приведенные в таблице, вполне допустимы, но эти значения охватывают все атомы до сих пор обнаружены.
Для данного значения главного квантового числа n возможные значения ℓ находятся в диапазоне от 0 до n - 1; следовательно, оболочка n = 1 имеет только подоболочку s и может принимать только 2 электрона, оболочка n = 2 имеет подоболочку s и p и может принимать всего 8 электронов, оболочка n = 3 имеет s, p и d подоболочки и имеет максимум 18 электронов и т. д.
А упрощенные модели одноэлектронных приводит к уровням энергии в зависимости от основного числа в одиночку. В более сложных атомах эти энергетические уровни разделены для все п gt; 1, помещая состояния высшего л выше состояний нижнего л. Например, энергия 2p выше, чем 2s, 3d встречается выше, чем 3p, что, в свою очередь, превышает 3s, и т. Д. Этот эффект в конечном итоге формирует блочную структуру периодической таблицы. Ни один из известных атомов не имеет электрона с ℓ выше трех ( f) в основном состоянии.
Угловой момент квантовое число, ℓ, регулирует количество плоских узлов, идущих через ядро. Плоский узел можно описать в электромагнитной волне как среднюю точку между гребнем и впадиной, которая имеет нулевые величины. На s-орбитали никакие узлы не проходят через ядро, поэтому соответствующее азимутальное квантовое число ℓ принимает значение 0. На p- орбитали один узел пересекает ядро, и поэтому ℓ имеет значение 1. имеет значение.
В зависимости от значения п, есть угловой момент квантового числа ℓ и следующий ряд. Приведены длины волн для атома водорода :
Учитывая квантованный полный угловой момент, который является суммой двух отдельных квантованных угловых моментов и,
квантовое число связанных с его величиной может варьироваться от до в целых шагах, где и являются квантовыми числами, соответствующих величинам индивидуальных моментов.
 «Векторные конусы» полного углового момента J (фиолетовый), орбитали L (синий) и спина S (зеленый). Конусы возникают из-за квантовой неопределенности между измерением компонент углового момента (см. Векторную модель атома ).
«Векторные конусы» полного углового момента J (фиолетовый), орбитали L (синий) и спина S (зеленый). Конусы возникают из-за квантовой неопределенности между измерением компонент углового момента (см. Векторную модель атома ). Из-за спин-орбитального взаимодействия в атоме ни орбитальный угловой момент, ни спин больше не коммутируют с гамильтонианом. Поэтому они со временем меняются. Однако полный угловой момент J коммутирует с одноэлектронным гамильтонианом и поэтому является постоянным. J определяется через
L - орбитальный угловой момент, а S - спин. Полный угловой момент удовлетворяет тем же коммутационным соотношениям, что и орбитальный угловой момент, а именно
из чего следует
где J i обозначает J x, J y и J z.
Квантовые числа, описывающие систему, которые постоянны во времени, теперь равны j и m j, определяемым посредством действия J на волновую функцию.
Таким образом, j относится к норме полного углового момента, а m j - к его проекции на заданную ось. Число j имеет особое значение для релятивистской квантовой химии, часто фигурируя в нижнем индексе в электронной конфигурации сверхтяжелых элементов.
Как и любой угловой момент в квантовой механике, проекция J вдоль других осей не может быть совместно определена с J z, потому что они не коммутируют.
J и т J вместе с четностью в квантовом состоянии, заменить три квантовые числа л, м л и м ы (проекция спина вдоль указанной оси). Первые квантовые числа могут быть связаны со вторыми.
Кроме того, собственные векторы из J, S, м J и четности, которые также собственные векторы этого гамильтониана, являются линейными комбинациями собственных векторов из л, с, м л и м ы.
Азимутальное квантовое число было перенесено из модели атома Бора и было установлено Арнольдом Зоммерфельдом. Модель Бора была получена из спектроскопического анализа атома в сочетании с атомной моделью Резерфорда. Было обнаружено, что самый нижний квантовый уровень имеет нулевой угловой момент. Орбиты с нулевым угловым моментом рассматривались как колеблющиеся заряды в одном измерении и поэтому описывались как «маятниковые» орбиты, но не были обнаружены в природе. В трехмерном пространстве орбиты становятся сферическими без каких-либо узлов, пересекающих ядро, подобно (в состоянии с наименьшей энергией) скакалке, которая колеблется в одном большом круге.