| Пар над безводным аммиаком |
|---|
| Темп. | Давление | ρ жидкости | ρ пара | Δпар H | | -78 ° C | 5.90 k Pa | | | | -75 ° C | 7,93 кПа | 0,73094 г / см | 7,8241 × 10 г / см | | | -70 ° C | 10,92 кПа | 0,72527 г / см | 1,1141 × 10 г / см | | | -65 ° C | 15,61 кПа | 0,71953 г / см | 1,5552 × 10 г / см | | | -60 ° C | 21,90 кПа | 0,71378 г / см | 2,1321 × 10 г / см | | | -55 ° C | 30,16 кПа | 0,70791 г / см | 2,8596 × 10 г / см | | | -50 ° C | 40,87 кПа | 0,70200 г / см | 3,8158 × 10 г / см | 1417 Дж / г | | -45 ° C | 54,54 кПа | 0,69604 г / см | 4,9940 × 10 г / см | 1404 Дж / г | | -40 ° C | 71,77 кПа | 0,68999 г / см | 6,4508 × 10 г / см | 1390 Дж / г | | -35 ° C | 93,19 кПа | 0,68385 г / см | 8,2318 × 10 г / см | 1375 Дж / г | | -30 ° C | 119,6 кПа | 0,67764 г / см | 1,0386 × 10 г / см | 1361 Дж / г | | -25 ° C | 151,6 кПа | 0,67137 г / см | 1,2969 × 10 г / см | 1345 Дж / г | | -20 ° C | 190,2 кПа | 0,66503 г / см | 1,6039 × 10 г / см | 1330 Дж / г | | -15 ° C | 236,3 кПа | 0,65854 г / см | 1,9659 × 10 г / см | 1314 Дж / г | | -10 ° C | 290,8 кПа | 0,65198 г / см | 2,3874 × 10 г / см | 1297 Дж / г | | -5 ° C | 354,8 кПа | 0,64533 г / см | 2,8827 × 10 г / см | 1280 Дж / г | | 0 ° C | 429,4 кПа | 0,63857 г / см | 3,4528 × 10 г / см | 1263 Дж / г | | 5 ° C | 515,7 кПа | 0,63167 г / см | 4,1086 × 10 г / см | 1245 Дж / г | | 10 ° C | 614,9 кПа | 0,62469 г / см | 4,8593 × 10 г / см | 1226 Дж / г | | 15 ° C | 728,3 кПа | 0,61755 г / см | 5,7153 × 10 г / см | 1207 Дж / г | | 20 ° C | 857,1 кПа | 0,61028 г / см | 6,6876 × 10 г / см | 1187 Дж / г | | 25 ° C | 1003 кПа | 0,60285 г / см | 7,7882 × 10 г / см | 1167 Дж / г | | 30 ° C | 1166 кПа | 0,59524 г / см | 9,03 · 10 × 10 г / см | 1146 Дж / г | | 35 ° C | 1350 кПа | 0,58816 г / см | 1,0431 × 10 г / см | 1124 Дж / г | | 40 ° C | 1554 кПа | 0,57948 г / см | 1.2006 × 10 г / см | 1101 Дж / г | | 45 ° C | 1781 кПа | 0,57130 г / см | 1,3775 × 10 г / см | 1083 Дж / г | | 50 ° C | 2032 кПа | 0,56287 г / см | 1,5761 × 10 г / см | 1052 Дж / г | | 55 ° C | 2310 кПа | 0,55420 г / см | | | | 60 ° C | 2613 кПа | 0,54523 г / см | 2,05 × 10 г / см | | | 65 ° C | 2947 кПа | 0,53596 г / см | | | | 70 ° C | 3312 кПа | 0,52632 г / см | 2,65 × 10 г / см | | | 75 ° C | 3711 кПа | 0,51626 г / см | | | | 80 ° C | 4144 кПа | 0,50571 г / см | 3,41 × 10 г / см | | | 85 ° C | 4614 кПа | 0,49463 г / см | | | | 90 ° C | 5123 кПа | 0,48290 г / см | 4,39 × 10 г / см | | | 95 ° C | 5672 кПа | 0,47041 г / см | | | | 100 ° C | 6264 кПа | 0,45693 г / см | 5,68 × 10 г / см | | | Темп. | Давление | ρ жидкости | ρ пара | Δпар H | | В приведенной выше таблице приведены свойства равновесия пар-жидкость безводный аммиак при различных температурах. Во втором столбце указано давление пара в k Па. Третий столбец - плотность жидкой фазы. Четвертый столбец - плотность пара. Пятая колонка - это теплота испарения, необходимая для превращения одного грамма жидкости в пар. |
| | 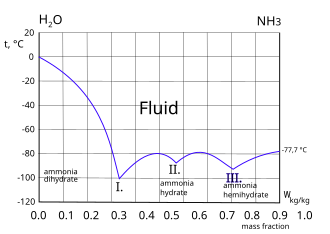 Кривая замерзания аммиачно-водяной системы. Три эвтектические точки I. II. и III. показаны. Слева от точки I. замороженный компонент - лед. Право III. точка замороженного компонента - аммиак. Кривая замерзания аммиачно-водяной системы. Три эвтектические точки I. II. и III. показаны. Слева от точки I. замороженный компонент - лед. Право III. точка замороженного компонента - аммиак. | Пар над водным раствором аммиака |
|---|
| Темп. | мас.% NH 3 | Парциальное давление. NH3 | Парциальное давление. H2O | | 0 ° C | 4,72 | 1,52 k Pa | 0,68 k Pa | | 9,15 | 3,31 k Pa | 0,71 k Pa | | 14,73 | 6,84 k Pa | 0,55 k Pa | | 19,62 | 11,0 k Pa | 0,40 k Pa | | 22,90 | 14,9 k Pa | 0,37 k Pa | | 10 ° C | 4,16 | 2,20 k Pa | 1,21 k Pa | | 8,26 | 4,96 k Pa | 1,17 k Pa | | 12,32 | 8,56 k Pa | 1,01 k Pa | | 15,88 | 12,68 k Pa | 0,93 k Pa | | 20,54 | 19,89 k Pa | 0,83 k Pa | | 21,83 | 22,64 k Pa | 0,73 k Pa | | 19,9 ° C | 4,18 | 3,65 k Pa | 2,19 k Pa | | 6,50 | 6,11 k Pa | 2,15 k Pa | | 6,55 | 6,13 k Pa | 2,13 k Pa | | 7,72 | 7,49 k Pa | 2,08 k Pa | | 10,15 | 10,75 k Pa | 2,01 k Pa | | 10,75 | 11,51 k Pa | 1,96 k Pa | | 16,64 | 22,14 k Pa | 1,72 k Pa | | 19,40 | 28,74 k Pa | 1,64 k Pa | | 23,37 | 40,32 k Pa | 1,37 k Pa | | 30,09 ° C | 3,93 | 5,49 k Pa | 4,15 k Pa | | 7,43 | 11,51 k Pa | 3,89 k Pa | | 9,75 | 16,00 k Pa | 3,80 k Pa | | 12,77 | 23,33 k Pa | 3,55 k Pa | | 17,76 | 3 8,69 k Pa | 3,31 k Pa | | 17,84 | 38,81 k Pa | 3,24 k Pa | | 21,47 | 53,94 k Pa | 2,95 k Pa | | 40 ° C | 3,79 | 8,15 k Pa | 7,13 k Pa | | 7,36 | 17,73 k Pa | 6,76 k Pa | | 11,06 | 29,13 k Pa | 6,55 k Pa | | 15,55 | 47,14 k Pa | 5,52 k Pa | | 17,33 | 57,02 k Pa | | | 20,85 | 76,81 k Pa | 5,04 k Pa | | 50 ° C | 3,29 | 10,54 k Pa | 11,95 k Pa | | 5,90 | 20,17 k Pa | 11,61 k Pa | | 8,91 | 32,88 k Pa | 11,07 k Pa | | 11,57 | 45,56 k Pa | 10,75 k Pa | | 14,15 | 60,18 k Pa | 10,27 k Pa | | 14,94 | 64,94 k Pa | 10,03 k Pa | | 60 ° C | 3,86 | 18,25 k Pa | 19,21 k Pa | | 5,77 | 28,78 k Pa | | | 7,78 | 40,05 k Pa | 18,47 k Pa | | 9,37 | 50,09 k Pa | 18,07 k Pa | | 9,37 | 63,43 k Pa | 17,39 k Pa | | Темп. | мас.% NH 3 | Парциальное давление. NH3 | Парциальное давление. H2O |
|
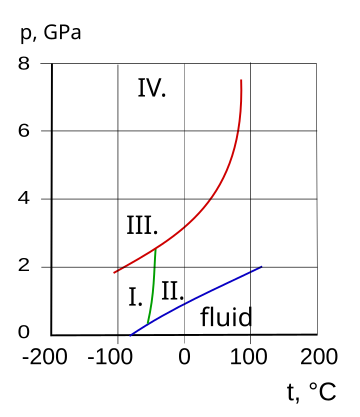 Фазовая диаграмма и кристаллические состояния аммиака. I. кубическая, II. ГПУ, III. ГЦК, IV. Орторомбическая
Фазовая диаграмма и кристаллические состояния аммиака. I. кубическая, II. ГПУ, III. ГЦК, IV. Орторомбическая 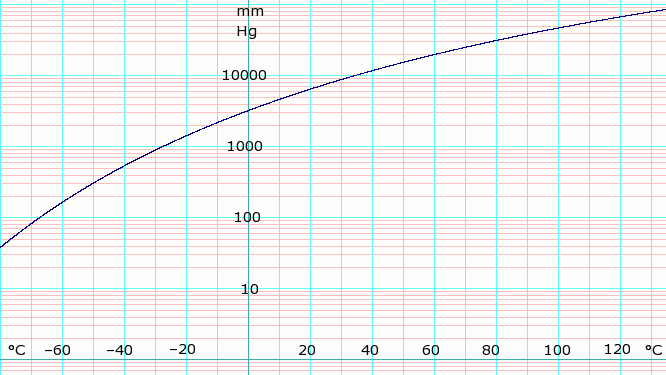 log 10 давления паров безводного аммиака. Используется формула, показанная ниже.
log 10 давления паров безводного аммиака. Используется формула, показанная ниже.  Кривая замерзания аммиачно-водяной системы. Три эвтектические точки I. II. и III. показаны. Слева от точки I. замороженный компонент - лед. Право III. точка замороженного компонента - аммиак.
Кривая замерзания аммиачно-водяной системы. Три эвтектические точки I. II. и III. показаны. Слева от точки I. замороженный компонент - лед. Право III. точка замороженного компонента - аммиак. 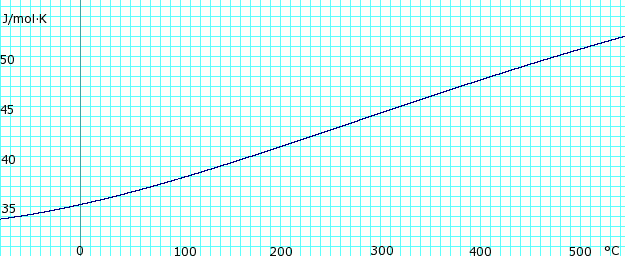 Теплоемкость, c p, безводного газообразного аммиака. Использует полином, полученный из CHERIC.
Теплоемкость, c p, безводного газообразного аммиака. Использует полином, полученный из CHERIC.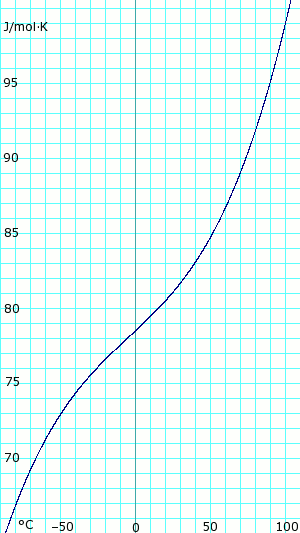 Теплоемкость безводного жидкого аммиака. Использует полином, полученный из CHERIC.
Теплоемкость безводного жидкого аммиака. Использует полином, полученный из CHERIC.