| Первичный (1 °) амин | Вторичный (2 °) амин | третичный (3 °) амин |
|---|---|---|
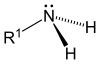 |  | 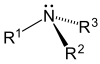 |
В органической химии, амины (, Великобритания также ) представляют собой соединения и функциональные группы, которые содержат основной атом азота атом с одинокая пара. Амины формально представляют собой производные аммиака, где один или несколько атомов водорода заменены заместителем, таким как алкил или арильная группа (они могут соответственно называться алкиламинами и ариламинами; амины, в которых оба типа заместителей присоединены к одному атому азота, могут называться алкилариламинами). Важные амины включают аминокислоты, биогенные амины, триметиламин и анилин ; список аминов см. в Категория: Амины. Неорганические производные аммиака также называют аминами, такими как монохлорамин (NClH 2).
Заместитель -NH 2 называется аминогруппа.
Соединения с атомом азота, присоединенным к карбонильной группе, таким образом имеющие структуру R – CO – NR'R ″, называются амидами и имеют химические свойства, отличные от аминов.
Амины можно классифицировать по природе и количеству заместителей на азоте. Алифатические амины содержат только Н и алкильные заместители. Ароматические амины имеют атом азота, связанный с ароматическим кольцом.
Амины, как алкил, так и арил, разделены на три подкатегории (см. Таблицу) в зависимости от количества атомов углерода, примыкающих к азоту:
Четвертая подкатегория определяется связностью заместителей, присоединенных к азоту:
Также возможно иметь четыре органических заместителя у азота. Эти частицы не являются аминами, но представляют собой катионы четвертичного аммония и имеют заряженный азотный центр. Соли четвертичного аммония существуют со многими видами анионов.
Амины называют несколькими способами. Обычно соединению дается префикс «амино-» или суффикс «-амин». Приставка «N-» означает замещение у атома азота. Органическое соединение с несколькими аминогруппами называется диамин, триамин, тетраамин и т. Д.
Систематические названия некоторых распространенных аминов:
| Низшие амины обозначаются суффиксом -амин..
| Высшие амины имеют префикс амино в качестве функциональной группы. Однако ИЮПАК не рекомендует это соглашение, а предпочитает форму алканамина, например пентан-2-амин..
|
Водородная связь значительно влияет на свойства первичных и вторичные амины. Например, метил и этил амины являются газами при стандартных условиях, тогда как соответствующие метил и этил спирты являются жидкостями. Амины обладают характерным запахом аммиака, жидкие амины - характерным «рыбным» запахом.
Атом азота имеет неподеленную электронную пару, которая может связывать H с образованием иона аммония R3NH. Неподеленная электронная пара представлена в этой статье двумя точками над или рядом с N. Растворимость в воде простых аминов повышается за счет водородной связи с участием этих неподеленных электронных пар. Обычно соли аммониевых соединений проявляют следующий порядок растворимости в воде: первичный аммоний (RNH. 3)>вторичный аммоний (R. 2NH. 2)>третичный аммоний (R 3 NH). Небольшие алифатические амины проявляют значительную растворимость во многих растворителях, тогда как амины с большими заместителями являются липофильными. Ароматические амины, такие как анилин, имеют неподеленную пару электронов , сопряженных с бензольным кольцом, таким образом, их склонность к образованию водородных связей снижается. У них высокая температура кипения и низкая растворимость в воде.
Обычно присутствие аминогруппы определяется комбинацией методов, включая масс-спектрометрию, а также спектроскопию ЯМР и ИК. Сигналы ЯМР 1Н для аминов исчезают после обработки образца D 2 O. В своем инфракрасном спектре первичные амины демонстрируют две полосы NH, тогда как вторичные амины демонстрируют только одну.
Алкиламины характеризуются тетраэдрическими характеристиками. азотные центры. Углы C-N-C и C-N-H приближаются к идеализированному углу 109 °. Расстояния C-N немного короче, чем расстояния C-C. Энергетический барьер для азотной инверсии стереоцентра составляет около 7 ккал / моль для триалкиламина. Взаимопревращение сравнивают с переворачиванием открытого зонта на сильный ветер.
Амины типа NHRR 'и NRR'R ″ являются хиральными : азотный центр имеет четыре заместителя, считая неподеленную пару. Из-за низкого барьера для инверсии амины типа NHRR 'не могут быть получены с оптической чистотой. Для хиральных третичных аминов NRR'R ″ может быть разделен только тогда, когда группы R, R 'и R ″ ограничены циклическими структурами, такими как N-замещенные азиридины (четвертичные аммониевые соли разрешимы).
 | ⇌ |  |
| Инверсия амина. Пара точек представляет неподеленную электронную пару на атоме азота. | ||
В ароматических аминах («анилинах») азот часто почти плоский из-за конъюгации неподеленной пары с арильным заместителем. Соответственно, расстояние C-N короче. В анилине расстояние C-N такое же, как расстояние C-C.
Как и аммиак, амины являются основаниями. По сравнению с гидроксидами щелочных металлов амины слабее (см. Таблицу для примеров значений сопряженной кислоты Ka).
| Алкиламин или анилин | pKaпротонированного амина | Kb |
|---|---|---|
| метиламин (MeNH 2) | 10,62 | 4,17E-04 |
| диметиламин (Me 2 NH) | 10,64 | 4.37E-04 |
| триметиламин (Me 3 N) | 9,76 | 5,75E-05 |
| этиламин (EtNH 2) | 10,63 | 4,27E-04 |
| анилин (PhNH 2) | 4,62 | 4,17E- 10 |
| 4-метоксианилин (4-MeOC 6H4NH2) | 5,36 | 2,29E-09 |
| N, N-диметиланилин (PhNMe 2) | 5,07 | 1,17E-09 |
| 3-нитроанилин (3-NO 2-C6H4NH2) | 2,46 | 2,88E-12 |
| 4-нитроанилин (4-NO 2-C6H4NH2) | 1 | 1,00E -13 |
| 4-трифторметиланилин (CF 3C6H4NH2) | 2,75 | 5,62E-12 |
Основность аминов зависит от:
из-за индуктивные эффекты, основные Можно ожидать, что эффективность амина будет возрастать с увеличением количества алкильных групп в амине. Корреляции усложняются из-за эффектов сольватации, противоположных тенденциям индуктивных эффектов. Эффекты сольватации также преобладают над основностью ароматических аминов (анилинов). Для анилинов неподеленная пара электронов на азоте делокализируется в кольцо, что приводит к снижению основности. Заместители в ароматическом кольце и их положения относительно аминогруппы также влияют на основность, как показано в таблице.
Сольватация значительно влияет на основность аминов. Группы N-H сильно взаимодействуют с водой, особенно с ионами аммония. Следовательно, основность аммиака увеличивается на 10 за счет сольватации. Собственная основность аминов, то есть ситуация, когда сольватация не важна, оценивалась в газовой фазе. В газовой фазе амины проявляют основность, предсказанную на основе эффектов высвобождения электронов органических заместителей. Таким образом, третичные амины являются более основными, чем вторичные амины, которые более основными, чем первичные амины, и, наконец, аммиак является наименее основным. Порядок pK b (основности в воде) не соответствует этому порядку. Точно так же анилин более щелочной, чем аммиак в газовой фазе, но в десять тысяч раз меньше в водном растворе.
В апротонных полярных растворителях, таких как ДМСО, ДМФ, и ацетонитрил энергия сольватации не так высока, как в протонных полярных растворителях, таких как вода и метанол. По этой причине основность аминов в этих апротонных растворителях почти полностью определяется электронными эффектами.
Промышленно значимые амины получают из аммиака алкилированием спиртами:
В отличие от реакции аминов с алкилгалогенидами, промышленный метод является зеленым, поскольку побочным продуктом является вода. Реакция аминов и аммиака с алкилгалогенидами используется для синтеза в лаборатории:
Такие реакции, которые наиболее полезны для алкилйодидов и бромидов, используются редко, потому что степень алкилирования трудно контролировать. Селективность можно улучшить с помощью реакции Делепина, хотя она редко применяется в промышленных масштабах.
Дизамещенные алкены реагируют с HCN в присутствии сильных кислот с образованием формамидов, которые можно декарбонилировать. Этот метод, реакция Риттера, может быть использован в промышленности для получения третичных аминов, таких как трет-октиламин.
Гидроаминирование алкенов также широко практикуется. Реакция катализируется твердыми кислотами.
В процессе гидрирования нитрилы восстанавливаются до аминов с использованием водорода в наличие никелевого катализатора. Реакции чувствительны к кислым или щелочным условиям, которые могут вызвать гидролиз группы –CN. LiAlH 4 чаще используется для восстановления нитрилов в лабораторных масштабах. Подобным образом LiAlH 4 восстанавливает амиды до аминов. Многие амины получают из альдегидов и кетонов посредством восстановительного аминирования, которое может протекать либо каталитически, либо стехиометрически.
Анилин (C6H5NH2) и его производные получают восстановлением нитроароматических соединений. В промышленности предпочтительным восстановителем является водород, тогда как в лаборатории часто используются олово и железо.
Существует множество способов получения аминов, многие из которых являются довольно специализированными.
Помимо их основности, доминирующей реакционной способностью аминов является их нуклеофильность. Большинство первичных аминов являются хорошими лигандами для ионов металлов с образованием координационных комплексов. Амины алкилируются алкилгалогенидами. Ацилхлориды и ангидриды кислот реагируют с первичными и вторичными аминами с образованием амидов («реакция Шоттена-Баумана »).
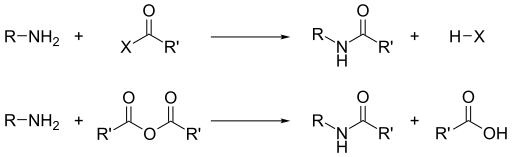
Аналогичным образом с сульфонилхлоридами получают сульфонамиды. Это превращение, известное как реакция Хинсберга, представляет собой химический тест на присутствие аминов.
Поскольку амины являются основными, они нейтрализуют кислоты с образованием соответствующих солей аммония R3NH. При образовании из карбоновых кислот и первичных и вторичных аминов эти соли термически дегидратируются с образованием соответствующих амидов.
![{\displaystyle {\underbrace {\ce {H-\!\!{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!\!\!:}} _{amine}+\underbrace {\ce {R3-{\overset {\displaystyle O \atop \|}{C}}-OH}} _{\text{carboxylic acid}}->} \ \ underbrace {\ ce {{H - {\ overset {\ displaystyle R1 \ atop |} {\ underset {| \ atop \ displaystyle R2} {N +}}} - H} + R3-COO ^ {-}}} _ {{\ text {замещенный-аммоний}} \ attop {\ text {карбоксилатная соль}}} {\ ce { ->[тепло] [обезвоживание]}} {\ underbrace {\ ce {{\ overset {\ displaystyle R1 \ atop |} {\ underset {| \ на \ displaystyle R2} {N}}} \! \! - {\ overset {\ displaystyle O \ atop \ |} {C}} - R3}} _ {амид} + \ underbrace {\ ce {H2O}} _ {вода}}}]( https://wikimedia.org/api/rest_v1/media/math/render/svg/ed9e4ee62efb585271572cbf0fd9149c90a400fd )
Амины реагируют с азотистой кислотой с образованием солей диазония. Соли алкилдиазония не имеют большого синтетического значения, поскольку они слишком нестабильны. Наиболее важными членами являются производные ароматических аминов, такие как анилин («фениламин») (A = арил или нафтил):

Анилины и нафтиламины образуют более стабильные соли диазония в кристаллической форме. Соли диазония претерпевают множество полезных превращений, включающих замену группы N 2 на анионы. Например, цианид меди дает соответствующие нитрилы:

Арилдиазониевые пары с богатыми электронами ароматическими соединениями, такими как фенол, образуют азосоединения. Такие реакции широко применяются для производства красителей.
Образование имина является важной реакцией. Первичные амины реагируют с кетонами и альдегидами с образованием иминов. формальдегида (R '= H), эти продукты обычно существуют в виде циклических тримеров.
Восстановление этих иминов дает вторичные амины:
Аналогичным образом вторичные амины реагируют с кетонами и альдегидами с образованием енамины :
Обзор реакций аминов приведен ниже:
Амины широко используются в биологии. При распаде аминокислот высвобождаются амины, что известно в случае разлагающейся рыбы, имеющей запах триметиламина. Многие нейротрансмиттеры представляют собой амины, включая адреналин, норэпинефрин, дофамин, серотонин и гистамин. Протонированные аминогруппы (–NH. 3) являются наиболее распространенными положительно заряженными фрагментами в белках, особенно в аминокислоте лизин. Анионный полимер ДНК обычно связан с различными белками, богатыми амином. Кроме того, концевой заряженный первичный аммоний на лизине образует солевые мостики с карбоксилатными группами других аминокислот в полипептидах, что является одним из основных факторов, влияющих на три -мерные структуры белков.
Первичные ароматические амины используются в качестве исходного материала для производства азокрасителей. Он реагирует с азотистой кислотой с образованием соли диазония, которая может вступать в реакцию сочетания с образованием азосоединения. Поскольку азосоединения сильно окрашены, они широко используются в красильной промышленности, например:
Многие препараты созданы для имитации или вмешательства в действие природных аминов нейротрансмиттеров, примером которых являются аминовые препараты:
Водный моноэтаноламин (MEA), дигликоламин (DGA), диэтаноламин (DEA), диизопропаноламин (DIPA) и метилдиэтаноламин (MDEA) широко используются в промышленности для удаления диоксида углерода (CO 2) и сероводорода (H2S) из природного газа и технологических потоков нефтепереработки. Они также могут использоваться для удаления CO 2 из дымовых газов и дымовых газов и могут иметь потенциал для снижения парниковых газов. Связанные процессы известны как подслащивание.
Простые амины с низким молекулярным весом, такие как этиламин, только слабо токсичны с LD50 между 100 и 1000 мг / кг.. Они раздражают кожу, особенно потому, что некоторые из них легко впитываются через кожу. Амины - это широкий класс соединений, и более сложные члены этого класса могут быть чрезвычайно биологически активными, например стрихнин и героин.
| Викицитатник содержит цитаты, относящиеся к: Амин |