| |||
| Имена | |||
|---|---|---|---|
| Систематическое название IUPAC Азанил (заместитель). Дигидридоназот (•) ( добавка) | |||
| Другие названия Амидоген; Аминильный радикал; Азаниловый радикал | |||
| Идентификаторы | |||
| Номер CAS | |||
| 3D-модель (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| PubChem CID | |||
InChI
| |||
SMILES
| |||
| Свойства | |||
| Химическая формула | NH. 2 | ||
| Молярная масса | 16,0226 г моль | ||
| Термохимия | |||
| Стандартная молярная. энтропия (S 298) | 194,71 JK моль | ||
| Стандартная энтальпия образования. (ΔfH298) | 190,37 кДж моль | ||
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки в информационном окне | |||
амино радикал, . NH. 2, также известный как аминильный радикал или азанильный радикал, представляет собой нейтральную форму амид-иона (NH. 2). Аминил обладает высокой реакционной способностью и, следовательно, короткоживущим как и большинство радикалов, однако они составляют важную часть химии азота. При достаточно высокой концентрации При введении амино-радикалы димеризуются с образованием гидразина. Хотя NH 2 в качестве функциональной группы обычен в природе, образуя часть многих соединений (например, фенэтиламинов ), радикал не может быть выделен в свободной форме.
Исторически принято считать, что первый свободный радикал был идентифицирован Мозесом Гомбергом в 1900; этот радикал был трифенилметильным радикалом. В то время как в целом использование свободных радикалов в органических превращениях трудно контролировать, органический синтез со свободными радикалами начался в 1937 году с Хейеса и Уотерса. После 1940 года более глубокое понимание образования, структуры и реакций свободных радикалов показало, как управлять этими химически активными частицами в химических реакциях. Однако в 1970-х годах Лэмб и Джулия стали свидетелями появления новых синтетических методологий с использованием свободных радикалов. В настоящее время свободные радикалы широко используются в синтетических реакциях.
Аминорадикал имеет два характерных электронных состояния:
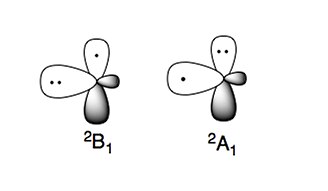
Более стабильное электронное состояние - это состояния B 1, где неспаренный электрон на p-орбитали, перпендикулярной плоскости молекулы (радикал π-типа). Электронное состояние с высокой энергией, A 1, имеет два электрона на p-орбитали и неспаренный электрон на sp-орбитали (орбиталь σ-типа).
Азотцентрированные соединения, такие как амины, являются нуклеофильными по своей природе, поэтому этот характер также наблюдается в амино-радикалах и может рассматриваться как нуклеофильные.
Амино-радикал демонстрирует только очень низкое оптическое поглощение в видимой области (λmax 530 нм, ε max 81 M s), в то время как его поглощение в УФ (<260 nm) is similar to that of OH. Due to this, it is impractical to determine the rate of reaction of the amino radical with organic compounds by following the decay of the amino radical.
Реакция 1: Образование Аминорадикал из аммиака
Аминорадикал может быть получен реакцией радикала ОН с аммиаком в облученных водных растворах. Эта реакция сформулирована как реакция отрыва водорода.
Константа скорости (k 1) для этой реакции была определена как 1,0 × 10 М с, в то время как параллельная реакция OH с NH. 4оказалась намного медленнее. был переопределен с использованием двух конкурентных методов импульсного радиолиза с ионами бензоата и тиоцианата при pH 11,4. Значение k 1 = (9 + 1) × 10 M s было получено из обеих систем. В кислом растворе соответствующая реакция • OH с NH. 4слишком медленная, чтобы ее можно было наблюдать с помощью импульсного радиолиза.
Реакция 2: Образование аминорадикала из гидроксиламина
Аминорадикал также может быть получен реакцией e (aq) с NH 2 OH. В нескольких исследованиях также использовалась окислительно-восстановительная система Ti-NH 2 OH для получения амино-радикалов с использованием спектроскопии электронного парамагнитного резонанса (ЭПР) и полярографии.
Реакция 3: Образование аминорадикала из аммониила
Восстановление гидроксиламина с помощью e (водн.) Также было предложено для образования аминорадикала в следующей реакции.
Ожидается, что реакционная способность аминорадикала в этой реакции будет зависеть от pH и должна происходить в диапазоне pH 3–7..
В общем, амино-радикалы обладают высокой реакционной способностью и короткоживущими; однако это не тот случай, когда он реагирует с некоторыми органическими молекулами. Сообщалось об относительной реакционной способности амино-радикала с несколькими органическими соединениями, но абсолютные константы скорости таких реакций остаются неизвестными. В реакции 1 была выдвинута гипотеза, что аминорадикал может реагировать с NH 3 быстрее, чем OH, и может окислять NH. 4с образованием аминорадикала в кислых растворах, учитывая, что радикалы являются более сильными окислителями, чем ОЙ. Чтобы проверить это, использовали сульфатные и фосфатные анион-радикалы. Было обнаружено, что сульфатные и фосфатные анионы-радикалы медленнее реагируют с NH 3, чем амино-радикалы, и они реагируют с аммиаком путем отщепления водорода, а не путем окисления с переносом электрона.
Когда амино радикал реагирует с ионами бензоата, константа скорости очень мала, и наблюдается только слабое поглощение в УФ-спектрах, что указывает на то, что амино-радикалы не реагируют быстро с бензолом. С другой стороны, фенол быстрее реагирует с амино-радикалом. В экспериментах при pH 11,3 и 12, с использованием 1,5 М NH 3 и различных концентраций фенола от 4 до 10 мМ, образование абсорбции феноксильного радикала наблюдали с константой скорости (3 + 0,4) × 10 мс. В этой реакции могут образовываться феноксильные радикалы с помощью двух возможных механизмов:
 Таблица 1: Скорость константы реакции радикалов NH 2. Эти константы скорости амино-радикальных реакций были измерены в 1978 г. в исследовании Neta et al. отслеживая кинетику образования образующихся радикалов. Наблюдения проводились на максимумах поглощения этих радикалов.
Таблица 1: Скорость константы реакции радикалов NH 2. Эти константы скорости амино-радикальных реакций были измерены в 1978 г. в исследовании Neta et al. отслеживая кинетику образования образующихся радикалов. Наблюдения проводились на максимумах поглощения этих радикалов.
Хотя известно, что амино-радикал является слабо реактивным, процесс рекомбинации двух амино-радикалов, по-видимому, является одним из самых быстрых. В результате он часто конкурирует с другими реакциями NH 2, и из этого следует, что механизм реакции включает аминорадикал.
Эта реакция является единственным путем исчезновения NH 2 и быстрее приближается к продуктам при низком давлении.
Свободные азотные радикалы вырабатываются организмом человека различными эндогенными системами. Баланс между свободными радикалами и антиоксидантами имеет решающее значение для правильного физиологического функционирования. Свободные радикалы могут отрицательно влиять на липиды, белки и ДНК и вызывать ряд заболеваний. Свободные радикалы возникают либо в результате нормальных основных метаболических процессов в организме человека, либо из внешних источников, таких как воздействие рентгеновских лучей, курение сигарет и промышленные химикаты. В клетках образование свободных радикалов происходит непрерывно в результате как ферментативных, так и неферментативных реакций. С другой стороны, свободные радикалы очень эффективны при проведении превращений в сильно затрудненных средах с высокой степенью хемоселективности, поскольку они маленькие и более проникающие, чем карбанионы и карбокатионы. Следовательно, молекулы, которые содержат много полярных функциональных групп, переносятся свободными радикалами.
Азотные радикалы и канцерогенез
Реактивные формы азота, такие как аминорадикал, играют важную роль в канцерогенезе. Они вызывают повреждение ДНК, поскольку реакция свободных радикалов с ДНК включает модификацию основания разрыва цепи и перекрестные связи белков ДНК. Следовательно, очевидно, что их присутствие в биосистемах может привести к мутации, трансформации и, в конечном итоге, к раку.
Антиоксиданты

Антиоксидант - это молекула, достаточно стабильная, чтобы отдавать электрон свободному радикалу и нейтрализовать его, тем самым уменьшая его способность повреждать. Некоторые из них вырабатываются в процессе нормального обмена веществ в организме, а другие содержатся в диете. Эти антиоксиданты задерживают или ингибируют повреждение клеток, главным образом, благодаря их способности улавливать свободные радикалы, поскольку они могут безопасно взаимодействовать со свободными радикалами и прекращать цепную реакцию до того, как будут повреждены жизненно важные молекулы. Существует два основных механизма действия антиоксидантов:
В биологических системах антиоксиданты проявляют свое действие посредством различных механизмов, включая донорство электронов, хелатирование ионов металлов, соантиоксиданты или регуляцию экспрессии генов.