При исследовании горения существует два типа температуры адиабатического пламени в зависимости от того, как завершается процесс: постоянный объем и постоянное давление; оба описывают температуру, которую продукты сгорания теоретически могут достичь, если энергия не будет потеряна во внешнюю среду.
постоянный объем адиабатическая температура пламени - это температура, которая возникает в результате полного процесса сгорания, который происходит без какой-либо работы, теплопередачи или изменений кинетической или потенциальной энергии. Его температура выше, чем при постоянном давлении, поскольку энергия не используется для изменения объема системы (т. Е. Для создания работы).
 Пропан
Пропан  Октан
Октан В повседневной жизни подавляющее большинство пламен, с которыми можно столкнуться, вызвано быстрым окислением углеводородов в таких материалах, как дерево, воск, жир, пластмассы, пропан и бензин. Температура адиабатического пламени при постоянном давлении таких веществ в воздухе находится в относительно узком диапазоне около 1950 ° C. Это связано с тем, что с точки зрения стехиометрии, горение органического соединения с n атомами углерода включает разрыв примерно 2n связей C – H, n связей C – C и 1,5n O 2 связей с образованием примерно n молекул CO 2 и n молекул H 2 O.
Поскольку большинство процессов сгорания, которые происходят естественным образом, происходят на открытом воздухе, нет ничего, что ограничивало бы газ определенным объемом, как цилиндр в двигателе. В результате эти вещества будут гореть при постоянном давлении, позволяя газу расширяться во время процесса.
При начальных атмосферных условиях (1 бар и 20 ° C) в следующей таблице перечислены температуры пламени для различных видов топлива при постоянном давлении. Указанные здесь температуры относятся к стехиометрической смеси (т.е. коэффициент эквивалентности φ = 1).
Обратите внимание, что это теоретические, а не фактические значения температуры пламени, создаваемые пламенем, которое не теряет тепла. Ближайшей будет самая горячая часть пламени, где реакция горения наиболее эффективна. Это также предполагает полное сгорание (например, идеально сбалансированное, недымное, обычно голубоватое пламя).
| Топливо | Окислитель |  | |
|---|---|---|---|
| (° C) | (° F) | ||
| Ацетилен (C 2H 2) | Воздух | 2500 | 4532 |
| Кислород | 3480 | 6296 | |
| Бутан (C 4H 10) | Воздух | 1970 | 3578 |
| Цианоген (C 2N 2) | Кислород | 4525 | 8177 |
| Дицианоацетилен (C 4N 2) | Кислород | 4990 | 9010 |
| Этан (C 2H 6) | Воздух | 1955 | 3551 |
| Этанол (C. 2H. 5OH) | Воздух | 2082 | 3779 |
| Бензин | Воздух | 2138 | 3880 |
| Водород (H 2) | Воздух | 2254 | 4089 |
| Магний (Mg ) | Воздух | 1982 | 3600 |
| Метан (C H 4) | Воздух | 1963 | 3565 |
| Метанол (C H 4O ) | Воздух | 1949 | 3540 |
| Природный газ | Воздух | 1960 | 3562 |
| Пентан (C 5H 12) | Воздух | 1977 | 3591 |
| Пропан (C 3H 8) | Воздух | 1980 | 3596 |
| Метилацетилен. (C 3H 4; Газ MAPP ) | Воздух | 2010 | 3650 |
| Кислород | 29 27 | 5301 | |
| Толуол (C 7H 8) | Воздух | 2071 | 3760 |
| Дерево | Воздух | 1980 | 3596 |
| Керосин | Воздух | 2093 | 3801 |
| Дизельное топливо | Воздух | 2104 | 3820 |
| Среднее жидкое топливо | Воздух | 2101 | 3815 |
| Мазут тяжелое | Воздух | 2102 | 3817 |
| Битумное Уголь | Воздух | 2172 | 3943 |
| Антрацит | Воздух | 2180 | 3957 |
| Кислород | ≈3500 | ≈6332 | |
| Алюминий | Кислород | 3732 | 6750 |
| Литий | Кислород | 2438 | 4420 |
| Фосфор (белый) | Кислород | 2969 | 5376 |
| Цирконий | Кислород | 4005 | 7241 |
 Первый закон термодинамики для замкнутой реакционной системы
Первый закон термодинамики для замкнутой реакционной системы Из первого закона термодинамики для замкнутой реакционной системы мы имеем,

где, 




и теплопередача отсутствует, поскольку процесс определен как адиабатический: 

 .
. Энтальпия График зависимости от температуры, иллюстрирующий расчет замкнутой системы
Энтальпия График зависимости от температуры, иллюстрирующий расчет замкнутой системы В случае температуры адиабатического пламени при постоянном давлении давление в системе поддерживается постоянным, что приводит к следующему уравнению для работы,

Снова нет теплопередачи, потому что процесс определен как адиабатический: 

Вспоминая определение энтальпии, получаем: 
 .
.Мы видим, что Температура адиабатического пламени процесса с постоянным давлением ниже, чем у процесса с постоянным объемом. Это связано с тем, что часть энергии, выделяющейся при сгорании, идет на изменение объема системы управления.
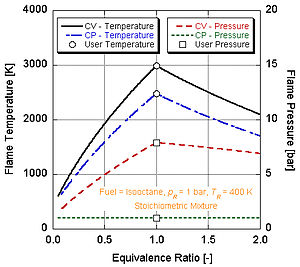 Адиабатические температуры и давления пламени как функция отношения воздуха к изооктану. Отношение 1 соответствует стехиометрическому соотношению
Адиабатические температуры и давления пламени как функция отношения воздуха к изооктану. Отношение 1 соответствует стехиометрическому соотношению 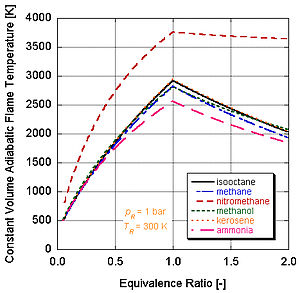 Постоянная объемная температура пламени ряда видов топлива с воздухом
Постоянная объемная температура пламени ряда видов топлива с воздухом Если мы сделаем предположение, что сгорание идет полностью (т.е. CO. 2и H. 2O), мы можем вычислить адиабатическую температуру пламени вручную либо в стехиометрических условиях, либо в обедненной стехиометрии (избыток воздуха). Это связано с тем, что имеется достаточно переменных и молярных уравнений, чтобы сбалансировать левую и правую части,

Богат стехиометрией, не хватает переменных, потому что сгорание не может быть завершено с как минимум CO и H. 2, необходимыми для молярного баланса (это наиболее распространенные неполные продукты сгорания),

Однако, если мы включим реакцию сдвига водяного газа,

и используйте константу равновесия для этой реакции у нас будет достаточно переменных, чтобы завершить расчет.
Различные виды топлива с разными уровнями энергии и молярными составляющими будут иметь разные адиабатические температуры пламени.
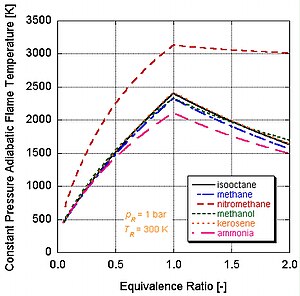 Температура пламени при постоянном давлении для ряда видов топлива, с воздухом
Температура пламени при постоянном давлении для ряда видов топлива, с воздухом 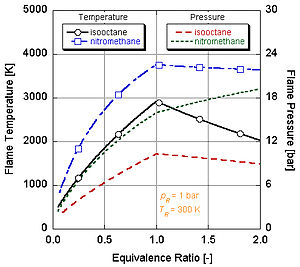 Нитрометан в зависимости от температуры и давления изооктана
Нитрометан в зависимости от температуры и давления изооктана Из следующего рисунка видно, почему нитрометан (CH 3NO2) является часто используется для увеличения мощности автомобилей. Поскольку каждая молекула нитрометана содержит два атома кислорода, он может гореть намного горячее, потому что вместе с топливом обеспечивает свой окислитель. Это, в свою очередь, позволяет ему создавать большее давление во время процесса постоянного объема. Чем выше давление, тем больше усилие на поршень создает больше работы и больше мощности в двигателе. Он остается относительно горячим и богатым по стехиометрии, потому что содержит собственный окислитель. Однако постоянная работа двигателя на нитрометане в конечном итоге приведет к расплавлению поршня и / или цилиндра из-за более высокой температуры.
 Влияние диссоциации на температуру адиабатического пламени
Влияние диссоциации на температуру адиабатического пламени В реальных приложениях полное сгорание обычно не происходит. Химия диктует, что диссоциация и кинетика изменят относительные составляющие продуктов. Существует ряд доступных программ, которые могут рассчитывать адиабатическую температуру пламени с учетом диссоциации через константы равновесия (Stanjan, NASA CEA, AFTP). На следующем рисунке показано, что эффекты диссоциации приводят к снижению температуры адиабатического пламени. Этот результат можно объяснить с помощью принципа Ле Шателье.