| Боковой амиотрофический склероз. (БАС) | |
|---|---|
| Другие названия | болезнь Лу Герига;. болезнь Шарко;. болезнь двигательных нейронов (БДН) |
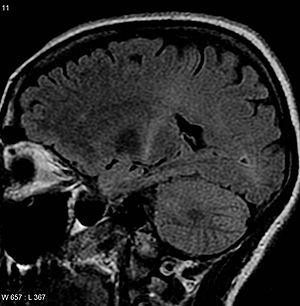 | |
| МРТ головного мозга с повышенным сигналом Т2 в задней части часть внутренней капсулы, которую можно отследить до моторной коры, что соответствует диагнозу ALS | |
| Speciality | Neurology |
| Симптомы | Жесткие мышцы, подергивания мышц, постепенное нарастание слабости |
| Осложнения | Затруднения в речи, глотании и дыхании ; дыхательная недостаточность |
| Обычное начало | 50–60 лет |
| Причины | Неизвестно (большинство), унаследовано (немного) |
| Метод диагностики | Предположительно на основании симптомы и подтверждены МРТ |
| Лечение | Неинвазивная вентиляция |
| Медикаменты | Рилузол, эдаравон |
| Прогноз | Ожидаемая продолжительность жизни 2–4 лет |
| Частота | 2,6 / 100000 в год (Европа) |
Боковой амиотрофический склероз (БАС ), также известный как болезнь Лу Герига в США и Канаде, и как заболевание двигательных нейронов (БДН ) в Великобритании и Австралии, является нейродегенеративным нервно-мышечным заболеванием что приводит к прогрессирующей потере двигательных нейронов, которые контролируют произвольные мышцы. БАС - наиболее распространенный тип болезни двигательных нейронов. Ранние симптомы БАС включают ригидность мышц, мышечные подергивания и постепенное нарастание слабости из-за истощения мышц в результате недостаточного использования мышц. Это может начаться со слабости в руках илиногах, когда это известно как начало конечностей, или с затруднения при речи или глотании, когда это называется бульбарным началом. Примерно у половины пострадавших развиваются, по крайней мере, легкие трудности с мышлением и поведением, и большинство людей испытывают боль. Пораженные мышцы отвечают за пережевывание пищи, речь и ходьбу. Потеря мотонейронов продолжается до тех пор, пока не теряется способность есть, говорить, двигаться и, наконец, дышать. БАС в конечном итоге вызывает паралич и раннюю смерть, обычно от дыхательной недостаточности.
. Большинство случаев БАС (от 90% до 95%) не имеют известной причины и известны как спорадический БАС. Однако предполагается, что в этом участвуют как генетические, так и факторы окружающей среды. Остальные 5–10% случаев имеют генетическую причину, связанную с историей болезни в семье, и они известны как семейный БАС. Примерно половина этих генетических случаев связана с одним из двух конкретных генов . Основной механизм включает повреждение как верхних, так и нижних мотонейронов. диагноз основан на признаках и симптомах человека, с проведением тестирования, чтобы исключить другие возможные причины.
Не существует лекарства от БАС, и лечение направлено на улучшение симптомов. Лекарство под названием рилузол может продлить жизнь примерно на два-три месяца. Неинвазивная вентиляция может улучшить как качество, так и продолжительность жизни. Механическая вентиляция может продлевает выживаемость, но не останавливает прогрессирование болезни. Может помочь зонд для кормления. Болезнь может поражать людей любого возраста, но обычно начинается в возрасте около 60 лет, а в наследственных случаях - в возрасте около 50 лет. Средняя выживаемость от начала до смерти составляет от двух до четырех лет, хотя это может варьироваться, ивыживают около 10%. дольше 10 лет, и смерть обычно наступает из-за дыхательной недостаточности. В Европе заболевание поражает примерно двух-трех человек на 100 000 в год. Ставки в большинстве стран мира неясны. В Соединенных Штатах это заболевание чаще встречается у белых людей, чем у черных людей.
. Описание болезни датируется по крайней мере 1824 годом Чарльзом Беллом. В 1869 году связь между симптомами и лежащими в их основе неврологическими проблемами была впервые описана Жан-Мартеном Шарко, который в 1874 году начал использовать термин боковой амиотрофический склероз. Он стал хорошо известен в Соединенных Штатах в 20 веке, когда в 1939 году он затронул бейсболиста Лу Герига, а затем во всем мире после диагноза 1963 года, поставленного космологом Стивеном Хокингом. Первый ген БАС был открыт в 1993 году, а первая животная модель была разработана в 1994 году. В 2014 году видеоролики Ice Bucket Challenge стали вирусными в Интернете и повысили осведомленность общественности о
БАС - это заболевание двигательных нейронов, также обозначаемое как заболевание двигательных нейронов, которое представляет группу неврологических нарушений, которые выборочно поражают двигательные нейроны, клетки, которые контролируют произвольные мышцы тела. Другие заболевания двигательных нейронов включают первичный боковой склероз (PLS), прогрессирующий m или нейроны в руках и ногах. Однако более 75% людей с явным PLS развивают более низкие двигательные нейронные признаки в течение четырех лет после появления симптомов, а это означает, что до тех пор нельзя поставить точный диагноз PLS. Прогноз PLS лучше, чем у классического ALS, поскольку он прогрессирует медленнее, приводит к меньшему функциональному снижению, не влияет на способность дышать и вызывает менее серьезную потерю веса.
Прогрессирующая мышечная атрофия (PMA) составляет около 5% всех случаев БАС поражает нижние мотонейроны рук и ног. Хотя ПМА в среднем ассоциируется с более длительным выживанием, чем классический БАС, со временем он все же прогрессирует в другие области спинного мозга, что в конечном итоге приводит к дыхательной недостаточности и смерти. Признаки верхних мотонейронов могут развиться на поздних стадиях ПМА, и в этом случае диагноз может быть изменен на классический БАС.
Региональные варианты БАС имеют симптомы, ограниченные единая область спинного мозга не менее года; они прогрессируют медленнее, чем классический БАС, и связаны с более длительным выживанием. Примеры включают синдром цепной руки, синдром цепной ноги и изолированный бульбарный БАС. Синдром цепной руки и синдром цепной ноги часто считают региональными вариантами PMA, поскольку они затрагивают только нижние двигательные нейроны. Изолированный бульбарныйБАС может затрагивать верхние или нижние двигательные нейроны. Эти региональные варианты БАС нельзя диагностируется при появлении симптомов; должна наблюдаться неспособность заболевания распространяться на другие области спинного мозга в течение длительного периода времени (не менее 12 месяцев).
Синдром цепной руки, также называемый плечевой амиотрофической диплегией, характеризуется нижним двигательным нейроном повреждение только шейного отдела спинного мозга, что приводит к постепенному появлению слабости в проксимальных мышцах руки и снижению или отсутствию рефлексов. Синдром цепной ноги, также называемый амиотрофической диплегией ног, характеризуется повреждением нижних мотонейронов только в пояснично-крестцовом отделе спинного мозга, что приводит к постепенному появлению слабости в ногах и снижению или отсутствию рефлексов. Изолированный бульбарный БАС характеризуется повреждением верхнего или нижнего мотонейрона только в бульбарной области, что приводит к постепенному возникновению затруднений с речью (дизартрия ) и глотанием (дисфагия ); дыхание (дыхание) обычно сохраняется, по крайней мере, изначально. Два небольших исследования показали, что люди с изолированным бульбарным БАС могут жить дольше, чем люди с бульбарным БАС.
БАС также можно классифицировать в зависимости от возраста начала. Хотя пиковый возраст начала составляет от 58 до 63 лет для спорадического БАС и от 47 до 52 лет для семейного БАС, около 10% всех случаев БАС начинаются в возрасте до 45 лет (БАС с «молодым началом»), и около 1% всех случаев начинается. до 25 лет (подростковый БАС). Люди, у которых развивается БАС в молодом возрасте, с большей вероятностью будут мужчинами, менее склонны к появлению бульбарных симптомов и с большей вероятностью будут иметь более медленное прогрессирование заболевания. Ювенильный БАС с большей вероятностью будет иметь семейный характер, чем БАС у взрослых; гены, известные каксвязанные с ювенильным БАС, включают ALS2, SETX, SPG11, FUS и SIGMAR1. Хотя большинство людей с ювенильным БАС живут дольше людей с БАС, начавшимся у взрослых, у некоторых из них есть специфические мутации в FUS и SOD1, которые связаны с плохим прогнозом. Позднее начало (после 65 лет) связано с более быстрым функциональным плохим и вегетативная нервная система, как правило, не затронута, то есть у большинства людей с БАС слух, зрение, прикосновение, запах и вкус.
Начало БАС может быть настолько незаметным, что симптомы не заметны. Самые ранние симптомы БАС - мышечная слабость или мышечная атрофия. Другие симптомы включают проблемы с глотанием или дыханием, спазмы или жесткость пораженных мышц; мышечная слабость, поражающая руку или ногу; или невнятная и гнусавая речь. Части тела, пораженные ранними симптомами БАС, зависят от того, какие двигательные нейроны в организме повреждаются первыми.
При БАС с началом конечностей первые симптомы проявляются в руках или ногах. Если сначала поражаются ноги, человек может чувствовать неловкость, спотыкаться или спотыкаться при ходьбе или беге; это часто отмечается при ходьбе с "опущенной ногой ", которая мягко волочится по земле. Если сначала поражаются руки, они могут испытывать трудности с задачами, требующими ловкости рук, такими как застегивание рубашки, письмо или поворот ключа в замке.
При БАС с бульбарным началом первыми симптомами являются трудности говорить или глотать. Речь может стать невнятной, носовой или более тихой. Могут возникнуть трудности с глотанием и потеря подвижности языка. Меньшая часть людей испытывает БАС с "респираторным началом", когда в первую очередь затрагиваются межреберные мышцы, поддерживающие дыхание.
Со временем люди испытывают все большие трудности при движении и глотании ( дисфагия ), и говорение или формирование слов (дизартрия ). Симптомы поражения верхних мотонейронов включают напряженные и жесткие мышцы (спастичность ) и преувеличенные рефлексы (гиперрефлексия ), включая сверхактивный рвотный рефлекс. Аномальный рефлекс, обычно называемый знаком Бабинского, также указывает на повреждение верхних мотонейронов. Симптомы дегенерации нижних мотонейронов включают мышечную слабость и атрофию, мышечные судороги и мимолетные подергивания мышц, которые можно увидеть под кожей (фасцикуляции). Однако подергивание - это скорее побочный эффект, чем диагностический симптом; оно возникает либо после слабости и атрофии, либо сопровождает их.
Хотя начальные симптомы и скорость прогрессирования варьируются от человека к человеку, болезнь в конечном итоге распространяется на незатронутые области, а пораженные области становятся больше затронуты. Большинство людей в конечном итоге теряют способность ходить или пользоваться руками и руками, теряют способность говорить и глотать пищу и собственную слюну и начинают терять способность кашлять и самостоятельно дышать.
Скорость прогрессирования можно измерить с помощью функциональной рейтинговой шкалы ALS - пересмотренной (ALSFRS-R), инструментального опроса из 12 пунктов, проводимого в виде клинического интервью или анкеты с самооценкой, которая дает оценку от 48 (нормальный функция) и 0 (тяжелая инвалидность); это наиболее часто используемый показатель результатов в клинических испытаниях, и врачи используют его для отслеживания прогрессирования заболевания. Хотя степень вариабельности высока и у небольшого процента людей заболевание протекает гораздо медленнее, в среднем люди с БАС теряют около 0,9 балла FRS в месяц. Исследование, проведенное среди клиницистов, показало, что они оценили изменение наклона ALSFRS-R на 20% как клинически значимое.
Прогрессирование заболевания, как правило,происходит медленнее у людей моложе 40 лет в начале, умеренно страдают ожирением, имеют симптомы, ограниченные в основном одной конечностью, и те, у которых в первую очередь проявляются симптомы верхних мотонейронов. и подверженность экологическим рискам на протяжении всей жизни.
БАС можно классифицировать как семейный или спорадический, в зависимости от наличия или отсутствия семейной истории болезни. Среди неврологов нет единого мнения о точном определении семейного БАС. Самым строгим определением является то, что человек с БАС должен иметь двух или более родственников первой степени (детей, братьев и сестер или родителей), у которых также есть БАС. Менее строгое определение заключается в том, что у человека с БАС должен быть хотя бы один родственник первой или второй степени (бабушка и дедушка, внуки, тети, дяди, племянники, племянницы или сводные братья и сестры), у которых также есть БАС.. Обычно считается, что на семейный БАС приходится 10% всех случаев БАС, хотя оценки варьируются от 5% до 20%. Более высокие оценки используют более широкое определение семейного БАС и более тщательно исследуют семейный анамнез людей с БАС.
При спорадическом БАС семейный анамнез заболевания отсутствует. Спорадический БАС и семейный БАС кажутся идентичными клинически и патологически и схожи генетически; около 10% людей со спорадическим БАС имеют мутации в генах, которые, как известно, вызывают семейный БАС. В свете этих параллелей термин «спорадический БАС» подвергался критике как вводящий в заблуждение, поскольку он подразумевает, что случаи спорадического БАС вызываются только факторами окружающей среды; термин «изолированный БАС» был предложен в качестве более точной альтернативы.
Более 20 генов были связаны с семейным БАС, из которых четыре являются причиной большинства семейных случаев: C9orf72 (40%), SOD1 (20%), FUS (1–5%) и TARDBP (1–5%). Генетика семейного БАС изучена лучше, чем генетика спорадического БАС; по состоянию на 2016 год известные гены БАС объяснили около 70% семейный БАС и около 15% спорадических БАС. В целом, у родственников первой степени родства человека с БАС риск развития БАС составляет 1%. БАС имеет олигогенный тип наследования, что означает, что для возникновения заболевания требуются мутации в двух или более генах.
БАС и лобно-височная деменция (ЛВД) теперь считаются частью общей спектр заболеваний (FTD – ALS) из-за генетического, клинического и патологического сходства. Генетически экспансии повторов C9orf72 составляют около 40% семейных БАС и 25% семейных ЛТД. Клинически 50% людей с БАС имеют некоторые когнитивные или поведенческие нарушения и 5-15% страдают ЛВС, в то время как 40% людей с ЛВС имеют некоторые симптомы двигательных нейронов, а 12,5% - БАС. Патологически аномальные агрегации белка TDP-43 наблюдаются у 97% пациентов с БАС и до 50% пациентов с ЛТД. Другие гены, которые, как известно, вызывают FTD-ALS, включают CHCHD10, SQSTM1 и TBK1.
Если семейная история болезни отсутствует - около 90% случаев - причина неизвестна. Возможные ассоциации, свидетельства которых неубедительны, включают военную службу и курение. Хотя исследования военной истории и частоты БАС противоречат друг другу, существуют слабые доказательства положительной корреляции. Различные предлагаемые факторы включают воздействие токсинов окружающей среды (по данным исследований географического распределения), а также употребление алкоголя и табака во время военной службы.
Обзор 16 метаанализов 2016 года показал, что есть были убедительными доказательствами связи с хроническим профессиональным воздействием свинца ; наводящие на размышления данные о сельском хозяйстве, воздействии тяжелых металлов, кроме свинца, потреблении бета-каротина и травмах головы; и слабые доказательства потребления омега-3 жирных кислот, воздействия чрезвычайно низкочастотных электромагнитных полей, пестицидов и мочевой кислоты в сыворотке крови.
В исследовании 2017 года, проведенном Центрами по контролю за заболеваниями США и «Профилактика», анализируя смертность в США с 1985 по 2011 гг., профессии, связанные со смертностью от БАС, были «белые воротнички», например, в сфере управления, финансов, архитектуры, вычислительной техники, юриспруденции и образования. Другие потенциальные факторы риска остаются неподтвержденными, включая химическое воздействие, воздействие электромагнитного поля, род занятий, физические травмы и поражение электрическим током. Существует предварительная связь с воздействием различных пестицидов, включая хлорорганические инсектициды альдрин, диэльдрин, ДДТ, и токсафен.
Обзор 2015 года показал, что умеренная и тяжелая черепно-мозговая травма является фактором риска БАС, но вопрос о том, увеличивается ли частота легкой черепно-мозговой травмы. не понятно. Мета-анализ 2017 года обнаружил связь между травмами головы и БАС; однако эта ассоциация исчезла, когда авторы рассмотрели возможность обратной причинно-следственной связи, которая заключается в том, что травмы головы являются ранним признаком недиагностированного БАС, а не причиной БАС.
В ряде обзоров не было обнаружено никакой связи между объемом физической активности и риском развития БАС. Обзор 2009 года показал, что доказательства того, что физическая активность является фактором риска БАС, были ограниченными, противоречивыми и недостаточного качества, чтобы сделать однозначный вывод. В обзоре 2014 года был сделан вывод о том, что физическая активность в целом не является фактором риска для БАС, что футбол и американский футбол, возможно, связаны с БАС, и что не было достаточно доказательств, чтобы сказать, связаны ли с БАСтяжелые для здоровья занятия. Обзор 2016 года нашел доказательства неубедительными и исследователями, что в исследованиях исследований затрудняют сравнение исследований, поскольку в них используются одни и те же показатели физической активности или одни и те же диагностические тесты для БАС.
И футбол, и знаменитый футбол как факторы риска. для БАС в нескольких исследованиях, хотя эта связь на небольших количествах БАС. Ретроспективное когортное исследование в 2012 году 3439 бывших игроков NFL показало, что их риск смерти от нейродегенеративных в три раза выше, чем у населения США в целом, а их риск смерти от БАС или болезни Альцгеймера был в четыре раза выше. Однако это исследование не дает окончательного доказательства того, что игра в американском футболе является фактором риска БАС, это означает, что это исследование не дает окончательного доказательства того, что игра в американский футбол является фактором риска БАС. Некоторые игроки НФЛ предположительно умеренную от БАС, на самом деле имели хроническую энцефалопатию (ХТЭ), нейродегенеративное заболевание, связанное с множественными травмами головы, которое может проявляться симптомами, очень похожими на БАС.
Футбол был идентифицирован как возможный анализ риска БАС в ретроспективном когортном 24 000 итальянских футболистов, игравших в период с 1960 по 1996 год. В этой группе было 375 смертей, в том числе восемь от БАС. Основываясь на этой информации и частотах БАС, былочитано, что вероятность смерти футболистов от БАС в 11 выше, чем у населения Италии в целом. Однако этот расчет подвергался критике за то, что он полагался на неоправданно низкое количество ожидаемых случаев БАС в когорте. Когда для прогнозирования ожидаемого количества случаев использовался пожизненный риск развития БАС, у футболистов не было больше шансов умереть от БАС, чем у населения в целом.
Курение, возможно, связано с ALS. Обзор 2009 г. пришел к выводу, что курение является установленным фактором риска БАС. Систематический обзор и метаанализ 2010 года пришли к выводу, что нет сильной связи между курением и БАС, но что курение может быть связано с более высоким риском БАС у женщин. Метаанализ 2011 года пришел к выводу, что курение увеличивает риск БАС по сравнению с никогда не курил. Среди курильщиков, чем моложе они начали курить, тем выше вероятность того, что они заболеют БАС; однако ни количество выкуриваемых в течение года сигарет, ни выкуриваемых за день сигарет не повлияли на их количество риска развития БАС.
Определяющим признаком БАС является смерть обоих верхних мотонейронов (среда в моторной коре головного мозга) и нижние мотонейроны (расположены в стволе и спинном мозге). При БАС с лобно-височной деменцией нейроны лобных и височных долей мозга также умирают. Патологическим признаком БАС присутствует телец включения (аномальных явлений белка), известных как тельца Бунина, в цитоплазме мотонейронов. Примерно у 97% людей с БАС основным компонентом телец включения белка TDP-43 ; однако у людей с мутациями SOD1 или FUS основным компонентом телец включения SOD1 или белка FUS, соответственно. грубая патология БАС, которые являются признаками заболеваний, которые можно увидеть невооруженным глазом, включают атрофию скелетных мышц, атрофию моторной коры, склероз кортикоспинальных и кортикобульбарный тракт, истончение подъязычных нервов (контролирующих язык) и истончение передних корешков спинного мозга. Помимо гибели моторных нейронов, две другие характеристики, общие для различных вариантов БАС, - это очаговая начальная патология, означающая, что симптомы начинаются в одной области спинного мозга, и прогрессирующее непрерывное распространение, что означает, что симптомы со временем распространяются на дополнительные области. Прион -подобное распространение неправильно свернутых белков от клетки клетке может объяснить, почему БАС начинается в одной области и распространяется на другие. глимфатическая также может быть вовлечена в патогенез БАС.
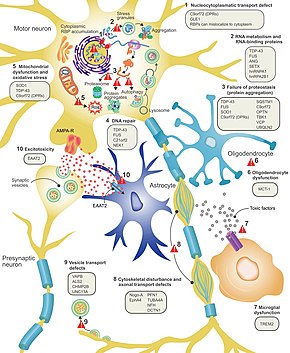 На этом рисунке показаны десять предложенных механизмов БАС и гены, связанных с этим заболеванием. C9orf72 является наиболее часто мутированным геном при БАС и вызывает гибель двигательных нейронов посредством ряда механизмов. Патогенная мутация представляет собой экспансию гексануклеотидного повтора (серия из шести нуклеотидов, повторяющаяся снова и снова); люди с 30 повторами являются нормальными, в то время как люди с сотнями или тысячами повторов могут иметь семейный БАС, лобно-височную деменцию или иногда спорадический БАС. Эти три механизма заболевания, связанные с этими повторами C9orf72, включают отложение РНК-транскриптов в ядре, трансляцию РНК в токсичные белки дипептидных повторов в цитоплазме и снижение уровня нормального белка C9orf72.
На этом рисунке показаны десять предложенных механизмов БАС и гены, связанных с этим заболеванием. C9orf72 является наиболее часто мутированным геном при БАС и вызывает гибель двигательных нейронов посредством ряда механизмов. Патогенная мутация представляет собой экспансию гексануклеотидного повтора (серия из шести нуклеотидов, повторяющаяся снова и снова); люди с 30 повторами являются нормальными, в то время как люди с сотнями или тысячами повторов могут иметь семейный БАС, лобно-височную деменцию или иногда спорадический БАС. Эти три механизма заболевания, связанные с этими повторами C9orf72, включают отложение РНК-транскриптов в ядре, трансляцию РНК в токсичные белки дипептидных повторов в цитоплазме и снижение уровня нормального белка C9orf72.
Эксайтотоксичность или Гибель нервных клеток, вызванная высоким уровнем внутриклеточного кальция из-за чрезмерной стимуляции возбуждающим нейромедиатором глутаматом, представляет собой механизм, который считается общим для всех форм БАС. Моторные нейроны более чувствительны к эксайтотоксичности, чем другие типы нейронов, потому что они имеют более низкую буферную способность кальция и тип рецептора глутамата (рецептор AMPA ), который более проницаем для кальция. При БАС наблюдаются пониженные уровни транспортера возбуждающих аминокислот 2 (EAAT2 ), который является основным транспортером, удаляющим глутамат из синапса; это приводит к повышению уровня синаптического глутамата и эксайтотоксичности. Рилузол, препарат, который незначительно продлевает выживаемость при БАС, подавляет высвобождение глутамата пресинаптическими нейронами; однако неясно, отвечает ли этот механизм за его терапевтический эффект.
 МРТ (аксиальный FLAIR ) демонстрирует усиление сигнала T2 в задней части внутренняя капсула, что соответствует диагнозу БАС.
МРТ (аксиальный FLAIR ) демонстрирует усиление сигнала T2 в задней части внутренняя капсула, что соответствует диагнозу БАС. Ни один тест не может поставить точный диагноз БАС, хотя наличие признаков верхнего и нижнего мотонейрона в одной конечности является сильным признаком. Вместо этого диагноз БАС в первую очередь основывается на симптомах и признаках, которые врач наблюдает у человека, и на серии тестов, чтобы исключить другие заболевания. Врачи собирают полную историю болезни и обычно проводят неврологическое обследование через регулярные промежутки времени, чтобы определить, усиливаются ли такие симптомы, как мышечная слабость, атрофия мышц, гиперрефлексия и спастичность. Ряд биомаркеров этого состояния изучается, но пока они не используются в медицине.
Диагностика БАС основана на пересмотренных критериях Эль-Эскориала и Авадзи. критерии. Исходные критерии Эль-Эскориала имели четыре уровня диагностической достоверности, основанные на том, как задействована любая из четырех областей спинного мозга: бульбарный, шейный, грудной и поясничный. Определенный БАС был определен как признаки верхнего двигательного нейрона (UMN) и нижнего двигательного нейрона (LMN) в трех областях спинного мозга, вероятный БАС как признаки UMN и LMN в двух областях, возможный БАС как признаки UMN и LMN только в одной области и предполагаемый ALS только как LMN. Пересмотренные критерии Эль-Эскориал, также известные как критерии Эйрли-Хауса, исключили категорию «подозреваемого БАС» и добавили категорию «вероятный БАС, поддерживаемый лабораторией». Критерии Авадзи придают аномальным тестам ЭМГ тот же вес, что и клинические признаки дисфункции ЛМН, при постановке диагноза БАС, что делает ненужной категорию «вероятный БАС, поддерживаемый лабораторией». Единственные три категории в критериях Авадзи - это определенный БАС, вероятный БАС и возможный БАС.
Пересмотренные критерии Эль-Эскориала специфичны для БАС, что означает, что тот, кто соответствует критериям, с большой вероятностью будет иметь БАС; однако они не особенно чувствительны к БАС, а это означает, что тот, кто не соответствует критериям, все еще может иметь БАС. Их чувствительность особенно низка на ранних стадиях БАС. Критерии Awaji имеют лучшую чувствительность, чем критерии El Escorial Revised, особенно для БАС с бульбарным началом. Метаанализ 2012 года показал, что критерии, пересмотренные Эль-Эскориал, имели чувствительность 62,2%, тогда как критерии Авадзи имели чувствительность 81,1%; оба набора критериев имели специфичность около 98%. Критерии Эль-Эскориала были разработаны для стандартизации групп пациентов для клинических испытаний, но не так полезны в клинической практике; Возможный БАС, описанный в критериях Эль Эскориала, почти всегда клинически БАС.
Потому что симптомы БАС могут быть похожи на симптомы широкого ряда других, более излечимых заболеваний или расстройств., должны быть проведены соответствующие тесты, чтобы исключить возможность других условий. Одним из таких тестов является электромиография (ЭМГ), специальный метод записи, который определяет электрическую активность в мышцах. Определенные результаты ЭМГ могут подтвердить диагноз БАС. Другой распространенный тест измеряет скорость нервной проводимости (NCV). Специфические отклонения в результатах NCV могут указывать, например, на то, что у человека есть форма периферической невропатии (повреждение периферических нервов) или миопатия (мышечная болезнь), а не БАС. Хотя магнитно-резонансная томография (МРТ) часто является нормальной у людей с ранней стадией БАС, она может выявить доказательства других проблем, которые могут вызывать симптомы, таких как опухоль спинного мозга, рассеянный склероз, грыжа межпозвоночного диска в шее, сирингомиелия или шейный спондилез.
На основании симптомов и результатов осмотра и этих тестов пациента врач может назначить анализы крови и мочи, чтобы исключить возможность других заболеваний, а также стандартные лабораторные анализы. В некоторых случаях, например, если врач подозревает, что у человека может быть миопатия, а не БАС, может быть выполнена биопсия мышцы.
Некоторые инфекционные заболевания могут иногда вызывать симптомы, похожие на БАС, включая иммунодефицит человека. вирус (ВИЧ ), человеческий Т-лимфотропный вирус (HTLV), болезнь Лайма и сифилис. Неврологические расстройства, такие как рассеянный склероз, постполиомиелитный синдром, мультифокальная моторная невропатия, CIDP, спинальная мышечная атрофия и спинальная и бульбарная мышечная атрофия также может имитировать определенные аспекты заболевания, и ее следует учитывать.
БАС необходимо дифференцировать от «мимических синдромов БАС», которые представляют собой несвязанные расстройства, которые могут иметь сходные проявления и клинические особенности БАС или его вариантов. Из-за прогноза, связанного с этим диагнозом, и разнообразия заболеваний или расстройств, которые могут напоминать БАС на ранних стадиях заболевания, люди с симптомами БАС всегда должны получать заключение неврологического специалиста, чтобы исключить альтернативный диагноз. Миастенический синдром, также известный как синдром Ламберта-Итона, может имитировать БАС, и его первоначальное проявление может быть похоже на миастению (MG), излечимое аутоиммунное заболевание, которое иногда ошибочно принимают за БАС. Синдром доброкачественной фасцикуляции - это еще одно заболевание, которое имитирует некоторые из ранних симптомов БАС, но сопровождается нормальными показаниями ЭМГ и не приводит к серьезной инвалидности.
Однако в большинстве случаев БАС правильно поставлен диагноз, при этом процент ошибок при диагностике в крупных клиниках БАС составляет менее 10%. В одном исследовании было обследовано 190 человек, которые соответствовали диагностическим критериям БДН / БАС, а также были проведены лабораторные исследования в соответствии с протоколами исследований и регулярным мониторингом. У 30 из этих людей (16%) диагноз полностью изменился в период разработки клинического наблюдения. В том же исследовании трем людям был поставлен ложноотрицательный диагноз MG, который может имитировать БАС и другие неврологические расстройства, что привело к задержке диагностики и лечения. MG в высшей степени поддается лечению; ALS - нет.
Нет лекарства от ALS. Лечение направлено на лечение симптомов и оказание поддерживающей помощи с целью улучшения качества жизни и продления выживаемости. Лучше всего эту помощь оказывают многопрофильные бригады медицинских специалистов; Посещение многопрофильной клиники БАС связано с более длительной выживаемостью, меньшим количеством госпитализаций и улучшением качества жизни. Рилузол продлевает выживаемость примерно на 2–3 месяца. Эдаравон немного замедляет функциональное снижение в небольшом количестве количество людей с БАС; это дорого, и его необходимо вводить в виде ежедневных внутривенных инфузий, что может снизить качество жизни. Другие лекарства могут использоваться для лечения других симптомов.
Неинвазивная вентиляция (НИВЛ) является основным методом лечения дыхательной недостаточности при БАС. У людей с нормальной бульбарной функцией он продлевает выживаемость примерно на семь месяцев и улучшает качество жизни. Одно исследование показало, что НИВ неэффективны для людей с плохой бульбарной функцией, в то время как другое предполагало, что это может обеспечить умеренное улучшение выживаемости. Многие люди с БАС плохо переносят НИВЛ. Инвазивная вентиляция легких - это вариант для людей с запущенным БАС, когда НИВЛ недостаточно для купирования симптомов. В то время как инвазивная вентиляция продлевает выживаемость, продолжается прогрессирование заболевания и функциональное снижение. Это может снизить качество жизни людей с БАС или лиц, ухаживающих за ними. Инвазивная вентиляция чаще используется в Японии, чем в Северной Америке или Европе.
Физическая терапия может способствовать функциональной независимости с помощью аэробных упражнений, диапазона движений и упражнений на растяжку. Трудотерапия может помочь в повседневной жизни с помощью адаптивного оборудования. Логопедия может помочь людям с БАС, которым трудно говорить. Предотвращение потери веса и недоедания у людей с БАС улучшает как выживаемость, так и качество жизни. Изначально затруднение глотания (дисфагия) можно контролировать с помощью диетических изменений и методов глотания. зонд для кормления следует рассмотреть, если кто-то с БАС теряет 5% или более веса своего тела или если он не может безопасно глотать пищу и воду. Зонд для питания обычно вводится через чрескожный эндоскопический гастростом y (PEG). Нет достаточных доказательств того, что трубки с ПЭГ улучшают выживаемость. Введение ПЭГ обычно выполняется с целью улучшения качества жизни.
Паллиативная помощь должна начинаться вскоре после того, как кому-то поставлен диагноз БАС. Обсуждение вопросов в конце жизни дает людям с БАС время подумать о своих предпочтениях в отношении ухода в конце жизни и может помочь избежать нежелательных вмешательств или процедур. Уход в хосписе может улучшить лечение симптомов в конце жизни и увеличивает вероятность мирной смерти. В последние дни жизни опиоиды можно использовать для лечения боли и одышки, а бензодиазепины - для лечения тревоги.
 Химическая структура рилузола, лекарства, которое увеличивает выживаемость на 2–3 месяца.
Химическая структура рилузола, лекарства, которое увеличивает выживаемость на 2–3 месяца. Было обнаружено, что рилузол умеренно увеличивает выживаемость примерно на 2–3 месяца. Он может иметь большее преимущество в выживаемости для людей с бульбарным БАС. Это может работать за счет уменьшения высвобождения возбуждающего нейромедиатора глутамата из пресинаптических нейронов. Наиболее частыми побочными эффектами являются тошнота и недостаток энергии (астения ). Люди с БАС должны начать лечение рилузолом как можно скорее после постановки диагноза.
Эдаравон, как было показано, умеренно замедляет снижение функции в небольшой группе людей с ранней стадией БАС. Он может работать, защищая двигательные нейроны от окислительного стресса. Наиболее частыми побочными эффектами являются синяки и нарушение походки. Лечение эдаравоном дорогое и требует ежедневных часовых внутривенных инфузий в течение 10 дней в течение двух недель.
Другие лекарства могут использоваться для уменьшения усталости, облегчения мышечных судорог, контроля спастичности и уменьшения избытка слюны. и мокрота. Габапентин, прегабалин и трициклические антидепрессанты (например, амитриптилин ) могут использоваться при нейропатических боли, в то время как нестероидные противовоспалительные препараты (НПВП ), ацетаминофен и опиоиды можно использовать для ноцицептивной боли.
Депрессия может быть лечить селективными ингибиторами обратного захвата серотонина (СИОЗС) или трициклическими антидепрессантами, тогда как бензодиазепины можно использовать при тревоге. Не существует лекарств для лечения когнитивных нарушений / лобно-височной деменции (FTD); однако СИОЗС и нейролептики могут помочь в лечении некоторых симптомов ЛВД. Баклофен и тизанидин - наиболее часто используемые пероральные препараты для лечения спастичности; интратекальная баклофеновая помпа может использоваться при сильной спастичности. Атропин, скополамин, амитриптилин или гликопирролат могут быть назначены, когда люди с БАС начинают имеют проблемы с глотанием слюны (сиалорея ).
В обзоре 2017 г. сделан вывод о том, что мексилетин безопасен и эффективен для лечения судорог при БАС, на основе рандомизированного контролируемого исследования 2016 г. В исследовании 2020 г., AMX0035, комбинация фенилбутирата натрия и тауурурсодиола, как было показано, продлевает выживаемость пациентов на несколько месяцев.
 Неинвазивная вентиляция поддерживает дыхание с помощью маски для лица или носа, подключенной к аппарату ИВЛ.
Неинвазивная вентиляция поддерживает дыхание с помощью маски для лица или носа, подключенной к аппарату ИВЛ. Неинвазивная вентиляция (НИВ) является основным методом лечения дыхательной недостаточности при БАС и была первой доказано, что лечение улучшает как выживаемость, так и качество жизни. NIV использует лицевую или назальную маску, подключенную к аппарату ИВЛ, создает периодическое положительное давление для поддержки дыхания. Постоянное положительное давление не рекомендуется людям с БАС, потому что оно затрудняет дыхание. Первоначально НИВ применяют только ночью, потому что первым признаком дыхательной недостаточности является снижение газообмена (гиповентиляция ) во время сна; Симптомы, связанные с этой ночной гиповентиляцией, включают прерывистый сон, беспокойство, утренние головные боли и дневную усталость. По мере прогрессирования заболевания у людей с БАС появляется одышка в положении лежа, во время физической активности или разговора и, в конечном итоге, в состоянии покоя. Другие симптомы включают плохую концентрацию внимания, плохую память, спутанность сознания, инфекции дыхательных путей и слабый кашель. Дыхательная недостаточность является наиболее частой причиной смерти при БАС.
Важно контролировать респираторную функцию людей с БАС каждые три месяца, поскольку начало НИВЛ вскоре после появления респираторных симптомов связано с увеличением выживаемости. Это включает в себя опрос человека с БАС, есть ли у него какие-либо респираторные симптомы, и измерение его респираторной функции. Чаще всего используется измерение вертикальной жизненной емкости легких форсированной жизненной емкости легких (FVC), но это плохой способ определения ранней дыхательной недостаточности и не лучший выбор для людей с бульбарными симптомами, поскольку им трудно поддерживать плотное давление. уплотнение вокруг мундштука. Измерение ФЖЕЛ, когда человек лежит на спине (ФЖЕЛ на спине), является более точным показателем слабости диафрагмы, чем ФЖЕЛ в вертикальном положении. Нюхательное давление на вдохе через нос (SNIP) - это быстрый и удобный способ проверки прочности диафрагмы, на которую не влияет слабость бульбарных мышц. Если у кого-то с БАС есть признаки и симптомы дыхательной недостаточности, ему следует пройти дневной анализ газов крови на предмет гипоксемии (низкий уровень кислорода в крови) и гиперкапнии (слишком много углекислого газа в крови). Если их дневной анализ газов крови в норме, они должны иметь ночной образ жизни пульсоксиметрия для выявления гипоксемии во время сна.
Неинвазивная вентиляция продлевает выживаемость дольше, чем рилузол. Рандомизированное контролируемое исследование 2006 г. показало, что НИВЛ продлевают выживаемость примерно на 48 дней и улучшают качество жизни; однако также было обнаружено, что некоторым людям с БАС это вмешательство приносит больше пользы, чем другим. Для людей с нормальной или умеренно нарушенной бульбарной функцией NIV продлевает выживаемость примерно на семь месяцев и значительно улучшает качество жизни. Для людей с плохой бульбарной функцией НИВ не продлевает выживаемость и не улучшает качество жизни, хотя и улучшает некоторые симптомы, связанные со сном. Несмотря на очевидные преимущества НИВ, около 25–30% всех людей с БАС не переносят ее, особенно люди с когнитивными нарушениями или бульбарной дисфункцией. Результаты крупного когортного исследования 2015 года показывают, что НИВЛ может продлить выживание у людей с бульбарной слабостью, и поэтому НИВ следует предлагать всем людям с БАС, даже если есть вероятность, что они будут испытывать трудности с его переносимостью.
Инвазивная вентиляция обходит нос и рот (верхние дыхательные пути), делая разрез в трахее (трахеостомия ) и вставляя трубку, соединенную с вентилятором. Это вариант для людей с запущенным БАС, у которых респираторные симптомы плохо контролируются, несмотря на постоянное использование НИВ. Хотя инвазивная вентиляция продлевает выживаемость, особенно для людей моложе 60 лет, она не лечит лежащий в основе нейродегенеративный процесс. Человек с БАС будет продолжать терять двигательную функцию, что затрудняет общение и иногда приводит к синдрому запертости, при котором он полностью парализован, за исключением глазных мышц. Около половины людей с БАС, которые решили пройти инвазивную вентиляцию легких, сообщают о снижении качества их жизни, но большинство по-прежнему считают это удовлетворительным. Однако инвазивная вентиляция ложится тяжелым бременем на лиц, осуществляющих уход, и может снизить качество их жизни. Отношение к инвазивной вентиляции варьируется от страны к стране; около 30% людей с БАС в Японии выбирают инвазивную вентиляцию легких по сравнению с менее чем 5% в Северной Америке и Европе.
 Мужчина с БАС общается, указывая на буквы и слова с помощью закрепленного на голове лазерная указка.
Мужчина с БАС общается, указывая на буквы и слова с помощью закрепленного на голове лазерная указка. Физическая терапия играет большую роль в реабилитации людей с БАС. В частности, физиотерапевты, терапевты и логопеды могут ставить цели и способствовать получению преимуществ для людей с БАС, задерживая потерю силы, поддерживая выносливость, ограничивая боль, улучшая речь и глотание, предотвращая осложнения и способствуя функциональной независимости.
Трудотерапия и специальное оборудование, такое как вспомогательная техника, также могут повысить независимость и безопасность людей на протяжении всего курса лечения БАС. Мягкие, малоинтенсивные аэробные упражнения, такие как повседневная деятельность, ходьба, плавание и велотренажер, могут укрепить непораженные мышцы, улучшить здоровье сердечно-сосудистой системы и помочь людям бороться с усталостью и депрессией.. Ряд двигательных упражнений и упражнений на растяжку может помочь предотвратить болезненную спастичность и сокращение (контрактуру) мышц. Физиотерапевты и эрготерапевты могут порекомендовать упражнения, которые обеспечивают эти преимущества без переутомления мышц, потому что мышечное истощение может привести к ухудшению симптомов, связанных с БАС, вместо оказания помощи людям с БАС. Они могут предложить такие приспособления, как пандусы, скобы, ходунки, оборудование для ванных комнат (стулья для душа, стояки унитаза и т. Д.) И инвалидные коляски, которые помогают людям оставаться мобильными. Трудотерапевты могут предоставить или порекомендовать оборудование и адаптацию, чтобы позволить людям с БАС сохранять максимальную безопасность и независимость в повседневной деятельности, насколько это возможно.
Людям с БАС, которые испытывают трудности с речью или глотанием, может быть полезно работать с логопед. Эти специалисты в области здравоохранения могут обучать людей адаптивным стратегиям, например методам, помогающим им говорить громче и яснее. По мере развития БАС патологи речевого языка могут рекомендовать использование дополнительных и альтернативных средств связи, таких как голосовые усилители, устройства для генерации речи (или устройства передачи голоса) или низкотехнологичные методы общения, такие как устанавливаемый на голову лазер. указатели, доски с алфавитом или сигналы «да / нет». Речевые патологи могут также помочь людям с диагнозом БАС с нарушением глотания (дисфагией), которое может включать измененную диету, упражнения на глотание, компенсаторные стратегии. Людям с БАС может потребоваться установка трахеостомы, с которой помогут справиться SLP.
 A гастростомическая трубка вводится через стенку брюшной полости в желудок.
A гастростомическая трубка вводится через стенку брюшной полости в желудок. Предотвращает потерю веса и недоедание. у людей с БАС улучшает как выживаемость, так и качество жизни. Потеря веса при БАС вызвана истощением мышц из-за гибели двигательных нейронов, повышенным расходом энергии в покое и уменьшением потребления пищи. Затруднение глотания (дисфагия ) развивается примерно у 85% людей с БАС в какой-то момент на протяжении их болезни и является основной причиной снижения потребления пищи, что приводит к недоеданию и потере веса. Важно регулярно оценивать вес и способность глотать людей с БАС. Первоначально с дисфагией можно справиться с помощью изменений в диете и модифицированных методов глотания. Обычно сначала возникают трудности с глотанием жидкостей, с которыми можно справиться, переключившись на более густые жидкости, такие как фруктовый нектар или смузи, или добавив жидкие загустители к разжижающим жидкостям, таким как вода и кофе. Люди с БАС должны есть мягкую влажную пищу, которую легче проглотить, чем сухую, рассыпчатую или жевательную пищу. Их также следует проинструктировать о том, как правильно держать голову во время глотания, чтобы облегчить глотание. Существуют предварительные доказательства того, что высококалорийные диеты могут предотвратить дальнейшую потерю веса и улучшить выживаемость. Пациенты будут проходить логопедию, чтобы справиться с их дисфагией и постоянно оценивать наиболее безопасную и наименее строгую последовательность диеты.
A зонд для кормления следует учитывать, если человек с БАС теряет 5% или более веса своего тела или если он не может безопасно глотать пищу и воду. Он может иметь форму гастростомической трубки, в которой трубка вводится через стенку брюшной полости в желудок, или назогастрального зонда, в который вводят через через нос и вниз по пищеводу в желудок. Гастростомический зонд больше подходит для длительного использования, чем назогастральный зонд, который вызывает дискомфорт и может вызвать язвы пищевода. Зонд для питания обычно вводится с помощью чрескожной эндоскопической гастростомии (PEG). Есть некоторые свидетельства того, что трубку ПЭГ следует вводить до того, как жизненная емкость легких упадет ниже 50% от ожидаемой, поскольку низкая жизненная емкость легких может быть связана с более высоким риском осложнений. Однако крупное исследование 2015 года показало, что введение ПЭГ безопасно для людей с запущенным БАС и низкой жизненной емкостью, пока они находятся на НИВ во время процедуры.
Имеются слабые доказательства того, что трубки с ПЭГ улучшают выживаемость. Введение ПЭГ обычно выполняется с целью улучшения качества жизни путем поддержания питания и приема лекарств. Это снижает риск потери веса и обезвоживания, а также может уменьшить беспокойство из-за продолжительного приема пищи и уменьшения приема пищи.
Паллиативный уход, который облегчает симптомы и улучшает качество жизни без лечения основного заболевания, должна начаться вскоре после того, как кому-то поставлен диагноз БАС. Раннее обсуждение вопросов в конце жизни дает людям с БАС время подумать о своих предпочтениях в отношении ухода в конце жизни и может помочь избежать нежелательных вмешательств или процедур. Как только они будут полностью проинформированы обо всех аспектах различных мер по продлению жизни, они могут заполнить расширенные директивы, указывающие на их отношение к неинвазивной вентиляции, инвазивной вентиляции и зондам для кормления. На поздних стадиях заболевания затруднение речи из-за мышечной слабости (дизартрия ) и когнитивная дисфункция могут ухудшить их способность выражать свои пожелания относительно ухода. Продолжающаяся неспособность выяснить предпочтения человека с БАС может привести к незапланированным и потенциально нежелательным экстренным вмешательствам, таким как инвазивная вентиляция легких. Если люди с БАС или члены их семей не хотят обсуждать вопросы, связанные с завершением жизни, может быть полезно использовать введение гастростомии или неинвазивной вентиляции как возможность поднять этот вопрос.
Уход в хосписе или паллиативный уход в конце жизни особенно важен при БАС, поскольку помогает оптимизировать лечение симптомов и увеличивает вероятность мирной смерти. Неясно, когда именно начинается фаза конца жизни при БАС, но это связано со значительными трудностями в движении, общении и, в некоторых случаях, мышлении. Хотя многие люди с БАС боятся задохнуться (задохнуться), их можно заверить в том, что это происходит редко, примерно в 0–3% случаев. Около 90% людей с БАС умирают мирно. В последние дни жизни опиоиды можно использовать для лечения боли и одышки, а бензодиазепины можно использовать для лечения тревоги.
БАС является наиболее распространенным заболеванием двигательных нейронов у взрослых и третьим по распространенности нейродегенеративным заболеванием после болезни Альцгеймера и болезни Паркинсона. Во всем мире количество людей, у которых ежегодно развивается БАС, оценивается в 1,9 человека на 100 000 в год, в то время как количество людей, у которых есть БАС в любой момент времени, оценивается примерно в 4,5 человека на 100 000. В Европе количество новых случаев заболевания в год составляет около 2,6 человек на 100 000 человек, а число заболевших составляет 7–9 человек на 100 000 человек. Пожизненный риск развития БАС составляет 1: 350 для европейских мужчин и 1: 400 для европейских женщин. Мужчины имеют более высокий риск, главным образом потому, что спинальный БАС чаще встречается у мужчин, чем у женщин. Число людей с БАС в США в 2015 году составляло 5,2 человека на 100000 человек, и было больше среди белых, мужчин и людей старше 60 лет. Число новых случаев заболевания составляет около 0,8 человек на 100000 в год в Восточной Азии и около 0,7 человек на 100000 в год в Южной Азии. Около 80% эпидемиологических исследований БАС было проведено в Европе и США, в основном на лицах североевропейского происхождения. Недостаточно информации для определения показателей БАС в большей части мира, включая Африку, некоторые части Азии, Индию, Россию и Южную Америку. В западной части Тихого океана есть несколько географических кластеров, где, как сообщается, распространенность БАС в 50–100 раз выше, чем в остальном мире, включая Гуам, полуостров Кии в Японии и Западный регион. Новая Гвинея. Заболеваемость в этих областях снизилась с 1960-х годов; причина остается неизвестной.
Люди всех рас и этнических групп могут быть затронуты БАС, но это чаще встречается у белых, чем у африканцев, азиатов или латиноамериканцев. В Соединенных Штатах в 2015 году распространенность БАС среди белых составляла 5,4 человек на 100 000, в то время как среди черных - 2,3 человека на 100 000. Средний Запад имел самую высокую распространенность среди четырех регионов переписи США - 5,5 человек на 100 000, за ним следуют Северо-Восток (5,1), Юг (4,7) и Запад (4,4). На Среднем Западе и Северо-Востоке, вероятно, была более высокая распространенность БАС, потому что они имеют более высокую долю белых, чем Юг и Запад. Этнически смешанные группы населения могут иметь более низкий риск развития БАС; исследование, проведенное на Кубе, показало, что люди смешанного происхождения с меньшей вероятностью умирают от БАС, чем белые или черные. Также существуют различия в генетике БАС между разными этническими группами; наиболее распространенным геном БАС в Европе является C9orf72, за которым следуют SOD1, TARDBP и FUS, в то время как наиболее распространенным геном БАС в Азии является SOD1, за которым следуют FUS, C9orf72 и TARDBP.
 Расчетная распространенность БАС в Соединенных Штатах по возрастным группам, 2012–2015 гг.
Расчетная распространенность БАС в Соединенных Штатах по возрастным группам, 2012–2015 гг. БАС может поражать людей в любом возрасте, но пик заболеваемости приходится на 50–75 лет и резко снижается после 80 лет. Причина снижения заболеваемости среди пожилых людей неясна. Одна мысль заключается в том, что люди, дожившие до 80 лет, могут быть генетически не восприимчивы к развитию БАС; в качестве альтернативы, БАС у пожилых людей может остаться недиагностированным из-за сопутствующих заболеваний (других заболеваний, которые они имеют), трудностей на приеме у невролога или быстрой смерти от агрессивной формы БАС. В США в 2015 г. самая низкая распространенность была в возрастной группе 18–39 лет, а самая высокая - в возрастной группе 70–79 лет. Спорадический БАС обычно начинается в возрасте от 58 до 63 лет, в то время как семейный БАС начинается раньше, обычно от 47 до 52 лет. Согласно прогнозам, количество случаев БАС во всем мире увеличится с 222 801 в 2015 году до 376 674 в 2040 году, т.е. на 69%. Во многом это будет связано со старением населения мира, особенно в развивающихся странах.
 Французский невролог Жан-Мартен Шарко ввел термин «боковой амиотрофический склероз» в 1874 году.
Французский невролог Жан-Мартен Шарко ввел термин «боковой амиотрофический склероз» в 1874 году. Описание болезни датируется по крайней мере 1824 годом Чарльзом Беллом. В 1850 году Франсуа-Амилкар Аран был первым, кто описал заболевание, которое он назвал «прогрессирующей мышечной атрофией», формой БАС, при которой поражаются только нижние двигательные нейроны. В 1869 году связь между симптомами и основными неврологическими проблемами была впервые описана Жан-Мартеном Шарко, который впервые ввел термин «боковой амиотрофический склероз» в своей статье 1874 года. Синдром цепной руки, региональный вариант БАС, был впервые описан Альфредом Вульпианом в 1886 году. Синдром цепной ноги, другой региональный вариант БАС, был впервые описан Пьером Мари и его учеником Патрикиос в 1918 году.
В 1945 году американские военно-морские врачи сообщили, что БАС был в 100 раз более распространен среди народа чаморро на Гуаме, чем в остальном мире. В 1956 г. эндемичный для Гуама вариант БАС был назван «комплексом бокового амиотрофического склероза / паркинсонизма и деменции» (БАС / ПДК), поскольку он имел типичные симптомы БАС, сопровождаемые симптомами, подобными паркинсонизму ; название на местном языке - литико-бодифская болезнь. Несмотря на ряд генетических и экологических исследований, причина БАС / ПДК остается неизвестной. Пик заболеваемости пришелся на начало 1950-х годов и впоследствии неуклонно снижался, и к 1985 году заболеваемость БАС / ППК на Гуаме была примерно такой же, как и во всем остальном мире.
Первым геном, связанным с БАС, был SOD1, который был идентифицирован в 1993 году. Это привело к разработке первой животной модели ALS, трансгенной SOD1 мыши, в 1994 году. В декабре 1995 года рилузол стал первым лекарством от БАС, одобренным FDA. Затем она была одобрена в Европе в 1996 г. и в Японии в 1998 г. В 1996 г. впервые была опубликована Шкала функциональных рейтингов ALS (ALSFRS); это был вопросник из 10 пунктов, который измерял способность людей с БАС выполнять повседневную деятельность. В 1999 году шкала была изменена, чтобы больше внимания уделялось респираторным симптомам. Полученная в результате функциональная рейтинговая шкала БАС - пересмотренная (ALSFRS-R) представляет собой вопросник из 12 пунктов, в котором единственный вопрос о дыхании заменяется вопросом о одышке, ортопноэ и дыхательной недостаточности.
В 2006 году было обнаружено, что белок TDP-43 является основным компонентом телец включения, наблюдаемых как при БАС, так и при лобно-височной деменции (ЛВД), что свидетельствует о том, что БАС и ЛТД являются частью общего спектра заболеваний. Это привело к открытию в 2008 году, что мутации в TARDBP, гене, кодирующем TDP-43, являются причиной семейного БАС. В 2011 было обнаружено, что экспансии некодирующих повторов в C9orf72 являются основной причиной ALS и FTD. Эдаравон был одобрен для лечения БАС в Японии и Южной Корее в 2015 г. и в США в 2017 г. По состоянию на 2017 г. он не был одобрен для лечения БАС в Европе.
В 1950-х годах электродиагностическое тестирование (ЭМГ и NCV) начали использоваться для оценки клинически подозреваемого БАС. В 1969 г. Эдвард Х. Ламберт опубликовал первые диагностические критерии ЭМГ / NCS для БАС, состоящие из четырех результатов, которые, по его мнению, убедительно подтверждают диагноз. В 1990 г. Всемирная федерация неврологии (WFN) провела встречу в Эль-Эскориал, Испания, чтобы разработать точные диагностические критерии для БАС, которые помогут стандартизировать клинические испытания; итоговые критерии "Эль-Эскориала" были опубликованы в 1994 году. В 1998 году WFN провела еще одно собрание для пересмотра критериев в Эйрли-Хаус в Уоррентоне, Вирджиния ; итоговые критерии «Эйрли Хаус» или «Пересмотренный Эль-Эскориал» были опубликованы в 2000 году. В 2006 году на острове Авадзи в Японии было проведено совещание, на котором обсуждались способы использования тестов ЭМГ и NCV для более ранней диагностики БАС. ; итоговые критерии «Авадзи» были опубликованы в 2008 году.
 В некоторых странах, особенно в США, БАС называют «болезнью Лу Герига ».
В некоторых странах, особенно в США, БАС называют «болезнью Лу Герига ». Другие названия БАС включают болезнь Шарко, болезнь Лу Герига и болезнь двигательных нейронов. Amyotrophic происходит от греческого слова amyotrophia : a- означает «нет», myo означает «мышцы», а trophia означает «питание». Следовательно, амиотрофия означает «отсутствие питания мышц», что означает потерю сигналов, которые моторные нейроны обычно посылают мышечным клеткам; это приводит к характерной мышечной атрофии, наблюдаемой у людей с БАС. Боковой определяет области в спинном мозге человека, где расположены пораженные двигательные нейроны, управляющие мышцами. Склероз означает «рубцевание» или «затвердение» и относится к смерти мотонейронов в спинном мозге.
БАС иногда называют «болезнью Шарко», потому что Жан-Мартен Шарко первым связал клинические симптомы с патологией, обнаруженной при вскрытии. Термин неоднозначен и может также относиться к болезни Шарко – Мари – Тута и болезни суставов Шарко. Британский невролог Рассел Брэйн ввел термин «заболевание двигательных нейронов» в 1933 году, чтобы отразить его убеждение, что БАС, прогрессирующий бульбарный паралич и прогрессирующая мышечная атрофия - все это разные формы одного и того же заболевания, хотя «нейрон» - это можно было написать «нейрон». В некоторых странах, особенно в Соединенных Штатах, БАС называют "болезнью Лу Герига" после того, как американский бейсболист Лу Гериг, у которого развился БАС в 1938 году, был вынужден прекратить играть в бейсбол в 1939 году и умер от этого в 1941.
В Соединенных Штатах и континентальной Европе термины «БАС» или «болезнь Лу Герига» относятся ко всем формам заболевания, включая классический БАС, прогрессирующий бульбарный паралич, прогрессирующую мышечную атрофию и первичную латеральную склероз. В Соединенном Королевстве и Австралии термин «заболевание двигательных нейронов» используется для обозначения БАС; и другие заболевания, которые влияют на двигательные нейроны, рассматриваются отдельно от болезней двигательных нейронов.
 Воспроизвести медиа Студент, демонстрирующий проблему с ведром со льдом
Воспроизвести медиа Студент, демонстрирующий проблему с ведром со льдом В августе 2014 года была решена задача 1056>вирусный онлайн, широко известный как «ALS Ice Bucket Challenge ». Участники наполняют ведро льдом и водой, затем заявляют, кто их выдвинул для выполнения задания, и назначают трех других лиц по своему выбору для участия в нем. Затем участники выливают на себя ведра со льдом и водой. Однако это можно сделать и в другом порядке. Затем участники жертвуют не менее 10 долларов США (или аналогичную сумму в местной валюте) на исследование ALS в Ассоциации ALS, Институт развития терапии ALS, Общество БАС Канады или Ассоциация болезней двигательных нейронов ion в Великобритании. Ожидается, что все участники, которые откажутся, чтобы на них вылили лед и воду, пожертвуют не менее 100 долларов США на исследование ALS. По состоянию на июль 2015 года Ice Bucket Challenge собрал 115 миллионов долларов для ассоциации ALS. В конкурсе приняли участие многие знаменитости. Программа Ice Bucket Challenge была приписана помощи в сборе средств, которые способствовали открытию того, что ген NEK1 может потенциально способствовать развитию БАС.
 Некоторые из наиболее распространенных моделей, используемых для изучения БАС.
Некоторые из наиболее распространенных моделей, используемых для изучения БАС. Многие различные организмы используются в качестве моделей для изучения БАС, включая Saccharomyces cerevisiae (вид дрожжей), Caenorhabditis elegans (круглый червь), Drosophila mel anogaster (обыкновенная плодовая муха), Danio rerio (рыба данио), Mus musculus (домашняя мышь) и Rattus norvegicus (обыкновенная крыса). Ни одна из этих моделей не представляет в полной мере БАС у людей, отчасти потому, что большинство моделей на животных основаны на сверхэкспрессии гена, что означает, что в трансгенную модель вставлены множественные копии мутантного гена человека, а отчасти потому, что нервная система человека сильно отличается от этой.
Первой животной моделью БАС была трансгенная мышь SOD1, разработанная в 1994 году. Она экспрессирует около 20–24 копий мутантного гена SOD1 человека и воспроизводит большинство клинических и патологических данных. замечен при БАС. Хотя в настоящее время существует более 20 различных моделей мышей SOD1, модель SOD1 остается как наиболее широко используемой моделью мышей SOD1, так и наиболее широко используемой моделью мышей ALS в целом. Большая часть нынешнего понимания патофизиологии БАС пришла из изучения моделей мышей, которые сверхэкспрессируют мутантный SOD1, особенно мышей SOD1. Однако многие лекарственные мишени, эффективность которых у трансгенных мышей SOD1 оказалась неэффективной, в клинических испытаниях на людях; у других моделей SOD1 были подобные проблемы. Большинство из этих препаратов были идентифицированы как потенциально эффективные на основании единственного исследования на модели SOD1 грызунов, а затем потерпели неудачу в клинических испытаниях у пациентов, у которых в основном был спорадический БАС. Считается, что эти клинические испытания потерпели неудачу, потому что мутации SOD1 составляют только 2% всех случаев БАС и потому, что патология БАС SOD1, как полагают, отличается от всех других типов БАС; в нем отсутствуют аномальные агрегации белка TDP-43 или белка FUS, наблюдаемые почти во всех других случаях БАС.
По состоянию на 2018 год существует около 20 моделей мышей TARDBP, дюжина моделей мышей FUS и ряд моделей мышей C9orf72, PFN1 и UBQLN2. Существуют также новые методы разработки моделей на животных, включая вирусный трансгенез, в котором вирусы используются для доставки мутантных генов к животной модели, и CRISPR / Cas9, который может использоваться для дать животной модели несколько мутировавших генов. Оба эти метода быстрее и дешевле традиционных методов генной инженерии мышей; они также позволяют ученым изучать эффекты мутации у мышей с разным генетическим фоном, что лучше отражает генетическое разнообразие, наблюдаемое у людей.
Клеточные модели, используемые для стабилизации БАС, включают дрожжи Saccharomyces cerevisiae и крысы или мыши. мотонейроны в культуре. Модели мелких животных включают плодовую муху, круглого червя C. elegans и рыбок данио. Из этих трех наиболее широко используется плодовая мушка; у него короткий жизненный цикл, короткая продолжительность жизни, сложная нервная система и множество доступных генетических инструментов. C. elegans имеет короткий жизненный цикл, им легко манипулировать генетически, и у них простая, но хорошо изученная нервная система. У рыбок данио прозрачные эмбрионы, в которые можно вводить ДНК или РНК, и срок их жизни до двух лет. Индуцированные плюрипотентные стволовые клетки (ИПСК) могут использоваться для преобразования фибробластов кожи в мотонейроны. Теперь можно генерировать ИПСК у людей с БАС, которые затем можно преобразовать в двигательные нейроны спинного мозга, которые полезны для изучения механизмов заболевания и тестирования потенциальных лекарств от БАС. ИПСК позволяют моделировать спорадический БАС, что невозможно сделать с моделями на животных.
С 1960-х по 2014 год около 50 препаратов от БАС были протестированы в рандомизированных контролируемых испытаниях (РКИ); из них рилузол был единственным, который показал небольшое улучшение выживаемости. Протестированные препараты, эффективность которых не доказана в клинических испытаниях на людях, включают противовирусные препараты, антиэксайтотоксические препараты, факторы роста, нейротрофические факторы, противовоспалительные препараты, антиоксиданты, антиапоптотические препараты и препараты для улучшения функции митохондрий.
Анализ 23 крупных рандомизированных контролируемых исследований фазы II и III, которые потерпели неудачу в период с 2004 по 2014 год, показал, что их отсутствие успеха было обусловлено множеством серьезных причин. Эти испытания на людях были проведены на основе положительных результатов на трансгенных мышах SOD1, которые не являются хорошей животной моделью для спорадического БАС. Кроме того, в большинстве доклинических исследований мышам SOD1 давали препарат на пресимптоматической стадии; это снижает вероятность того, что результаты будут применимы к людям с БАС, которые начинают лечение намного позже появления симптомов. Положительные результаты небольших исследований фазы II на людях также могут вводить в заблуждение и приводить к неудаче в исследованиях фазы III. Другие потенциальные проблемы включали то, что лекарство не достигло предполагаемого места действия в центральной нервной системе и лекарственные взаимодействия между исследуемым препаратом и рилузолом.
Повторяющаяся транскраниальная магнитная стимуляция изучались при БАС в небольших и плохо спланированных клинических испытаниях; по состоянию на 2013 г. доказательств было недостаточно, чтобы знать, безопасна или эффективна рТМС при БАС. В одном обзоре исследований терапии стволовыми клетками, проведенном в 2016 году, были обнаружены предварительные доказательства того, что внутриоспинальная имплантация стволовых клеток была относительно безопасной и, возможно, эффективной. В Кокрановском обзоре 2019 года клеточной терапии было обнаружено, что недостаточно доказательств, чтобы строить предположения об эффективности. Маситиниб был одобрен как орфанный препарат в Европе и в других странах. США, исследования продолжаются с 2016 года. Бета-адренергические агонисты были предложены для лечения их воздействия на рост мышц и нейрозащиту, но исследований на людях недостаточно для определения их эффективности.
С открытием того, что TDP-43, FUS и C9orf72 могут вызывать БАС, а также связанные формы лобно-височной деменции (FTD / ALS) были предприняты активные усилия, чтобы понять, как эти мутации вызывают заболевание и могут ли быть важны другие нарушения функции белков. По состоянию на 2013 год выяснилось, что различия в метилировании остатков аргинина в белке FUS могут быть значимыми, а статус метилирования может быть способом отличить некоторые формы FTD от ALS.
| Викискладе есть материалы, связанные с боковым амиотрофическим склерозом. |
| Классификация | D |
|---|---|
| Внешние ресурсы |