Проект Проект 1000 геномов (сокращенно 1KGP ), запущенная в январе 2008 года, представляла собой международное исследовательское усилие по созданию наиболее подробного каталога генетических вариаций человека. Ученые планировали секвенировать геномы по крайней мере одной тысячи анонимных участников из ряда различных этнических групп в течение следующих трех лет, используя недавно разработанные технологии, которые были быстрее и дешевле. В 2010 году проект завершил пилотную фазу, о которой подробно рассказано в публикации в журнале Nature. В 2012 году в публикации Nature было объявлено о секвенировании 1092 генома. В 2015 году в двух статьях в Nature сообщалось о результатах, завершении проекта и возможностях для будущих исследований. Было выявлено множество редких вариаций, ограниченных близкородственными группами, и проанализировано восемь классов структурных вариаций.
Проект объединяет мультидисциплинарные исследовательские группы из институтов со всего мира, включая Китай, Италия, Япония, Кения, Нигерия, Перу, Соединенное Королевство и США. Каждый из них внесет свой вклад в огромный набор данных последовательностей и уточненную карту генома человека, которая будет доступна через общедоступные базы данных как для научного сообщества, так и для широкой публики.
Предоставляя обзор консорциум создаст ценный инструмент для всех областей биологической науки, особенно в таких дисциплинах, как генетика, медицина, фармакология, биохимия и биоинформатика.
 Изменения в количестве и порядке генов (AD) создают генетическое разнообразие внутри популяций и между ними.
Изменения в количестве и порядке генов (AD) создают генетическое разнообразие внутри популяций и между ними. С момента завершения проекта «Геном человека» продвигается вперед в человеческой популяционной генетике и сравнительной геномике позволили глубже понять природу генетического разнообразия. Однако мы только начинаем понимать, как такие процессы, как случайная выборка гамет, структурных вариаций (вставки / удаления (indels ), количество копий вариации (CNV), ретроэлементы ), однонуклеотидные полиморфизмы (SNP) и естественный отбор сформировали уровень и характер изменчивости внутри видов, а также между видами.
Случайная выборка гамет во время полового размножения приводит к генетическому дрейфу - случайным колебаниям популяционная частота признака - в последующих поколениях и приведет к потере всех вариаций при отсутствии внешнего влияния. Постулируется, что скорость генетического дрейфа обратно пропорциональна размеру популяции и что она может быть ускорена в определенных ситуациях, таких как узкие места, где размер популяции уменьшается на определенный период времени, и эффект основателя (индивиды в популяции, восходящие к небольшому количеству индивидов-основателей)
Anzai et al. продемонстрировали, что индели составляют 90,4% всех наблюдаемых вариаций в последовательности главного локуса гистосовместимости (MHC) между людьми и шимпанзе. После принятия во внимание множественных инделей высокая степень геномного сходства между двумя видами (98,6% идентичность нуклеотидной последовательности ) снижается до 86,7%. Например, большая делеция в 95 килобаз (т.п.н.) между локусами генов MICA и MICB человека приводит к единственный гибридный ген MIC шимпанзе, связывающий эту область с видоспецифической обработкой нескольких ретровирусных инфекций и результирующей восприимчивостью к различным аутоиммунным заболеваниям. Авторы делают вывод, что вместо более тонких SNP, индели были движущим механизмом в видообразовании приматов.
Помимо мутаций, SNP и других структурных вариантов, таких как Варианты с числом копий (CNV) вносят вклад в генетическое разнообразие в человеческих популяциях. Используя микроматрицы, почти 1500 вариабельных областей с числом копий, покрывающих около 12% генома и содержащих сотни генов, локусов заболеваний, функциональных элементов и сегментарных дупликаций, были идентифицированы в Коллекция образцов HapMap. Хотя конкретная функция CNV остается неуловимой, тот факт, что CNV охватывают большее количество нуклеотидов на геном, чем SNP, подчеркивает важность CNV для генетического разнообразия и эволюции.
Исследование геномных вариаций человека имеет большой потенциал для идентификации генов, которые могут лежат в основе различий в устойчивости к болезням (например, область MHC ) или метаболизме лекарств.
Естественный отбор в эволюции признака можно разделить на три класса. Направленный или положительный отбор относится к ситуации, когда определенный аллель имеет большую пригодность, чем другие аллели, следовательно, увеличивается его популяционная частота (например, устойчивость к антибиотикам бактерий). Напротив, стабилизирующий или отрицательный отбор (также известный как очищающий отбор) снижает частоту или даже удаляет аллели из популяции из-за связанных с ним недостатков по сравнению с другими аллелями. Наконец, существует ряд форм выбора балансировки ; они увеличивают генетическую изменчивость внутри вида за счет чрезмерного доминирования (гетерозиготные особи более приспособлены, чем гомозиготные особи, например, G6PD, ген, который участвует в обоих Гемолитическая анемия и устойчивость к малярии ) или могут пространственно варьироваться в пределах вида, который обитает в разных нишах, таким образом отдавая предпочтение разным аллелям. Некоторые геномные различия могут не влиять на фитнес. Нейтральная изменчивость, ранее считавшаяся «мусорной» ДНК, не подвержена влиянию естественного отбора, что приводит к более высокой генетической изменчивости на таких участках по сравнению с участками, где вариация действительно влияет на приспособленность.
Не совсем ясно, как естественный отбор имеет сформированные различия населения; тем не менее, генетические области-кандидаты в процессе отбора были идентифицированы недавно. Паттерны полиморфизмов ДНК могут использоваться для надежного обнаружения признаков отбора и могут помочь идентифицировать гены, которые могут лежать в основе вариаций устойчивости к болезням или метаболизма лекарств. Barreiro et al. обнаружили доказательства того, что отрицательный отбор снизил дифференциацию популяции на уровне изменения аминокислоты (особенно в генах, связанных с заболеванием), тогда как положительный отбор обеспечил региональную адаптацию популяций человека за счет увеличения дифференциации популяции в областях генов ( в основном несинонимичные и 5'-нетранслируемые области варианты).
Считается, что большинство сложных и менделевских болезней (за исключением болезней с поздним началом, если предположить, что пожилые особи больше не влияют на приспособленность своего потомства) будут влиять на выживание и / или воспроизводство, таким образом, генетические факторы, лежащие в основе этих болезней, должны находиться под влиянием естественного отбора. Хотя заболевания, которые сегодня проявились поздно, могли быть детскими болезнями в прошлом, поскольку гены, задерживающие прогрессирование болезни, могли пройти отбор. болезнь Гоше (мутации в гене GBA ), болезнь Крона (мутация NOD2 ) и семейная гипертрофическая кардиомиопатия (мутации в MYH7, TNNT2, TPM1 и MYBPC3 ) - все это примеры отрицательного отбора. Эти болезненные мутации в основном рецессивны и сегрегируют, как и ожидалось, с низкой частотой, что подтверждает предполагаемый отрицательный отбор. Есть свидетельства того, что генетическая основа диабета 1 типа могла пройти положительный отбор. Сообщалось о нескольких случаях, когда вызывающие заболевание мутации проявлялись с высокой частотой, поддерживаемой сбалансированным отбором. Наиболее ярким примером являются мутации локуса G6PD, где, если гомозиготный G6PD фермент дефицит и, следовательно, возникает гемолитическая анемия, но в гетерозиготном состоянии частично защищает от малярии. Другие возможные объяснения сегрегации аллелей болезни с умеренной или высокой частотой включают генетический дрейф и недавние изменения в сторону положительного отбора из-за изменений окружающей среды, таких как диета или генетический автостоп.
сравнительный анализ всего генома различных человеческие популяции, а также между видами (например, человек против шимпанзе) помогают нам понять взаимосвязь между болезнями и отбором и предоставить доказательства мутаций в ограниченных генах, которые непропорционально связаны с наследственными заболеваниями фенотипами. Гены, участвующие в сложных заболеваниях, как правило, подвергаются менее негативному отбору, чем гены менделевской болезни или гены, не связанные с болезнью.
Есть два вида генетических вариантов связанные с болезнью. Первые - это редкие генетические варианты, которые оказывают серьезное влияние преимущественно на простые признаки (например, Муковисцидоз, болезнь Хантингтона ). Вторые, более распространенные, генетические варианты обладают слабым эффектом и, как считается, связаны со сложными признаками (например, Познание, Диабет, Болезнь сердца ). Между этими двумя типами генетических вариантов лежит значительный пробел в знаниях, который призван восполнить проект «1000 геномов».
Основная цель этого проекта - создать полный и подробный каталог генетических вариации, которые, в свою очередь, могут быть использованы для ассоциативных исследований, связывающих генетические вариации с заболеванием. Таким образом, консорциум стремится обнаружить>95% вариантов (например, SNP, CNV, indels) с частотами минорных аллелей на уровне 1% по геному и 0,1-0,5% в областях генов, поскольку а также для оценки популяционных частот, фона гаплотипа и неравновесных сцеплений паттернов вариантных аллелей.
Вторичные цели будут включать поддержку лучшего SNP и выбор зонда для платформ для генотипирования в будущих исследованиях и усовершенствования эталонной последовательности человека. Кроме того, заполненная база данных будет полезным инструментом для изучения регионов, находящихся в процессе отбора, вариабельности в нескольких популяциях и понимания основных процессов мутации и рекомбинации.
генома человека состоит примерно из 3 миллиардов пар оснований ДНК и, по оценкам, несет около 20 000 белков, кодирующих гены. При разработке исследования консорциуму необходимо было решить несколько важных вопросов, касающихся показателей проекта, таких как технологические проблемы, стандарты качества данных и охват последовательностей.
В течение следующих трех лет ученые из Sanger Институт, BGI Shenzhen и крупномасштабная сеть секвенирования Национального института генома человека Национального института генома человека планируют секвенировать не менее 1000 геномов человека. Из-за большого количества данных о последовательностях, которые необходимо сгенерировать и проанализировать, возможно, что со временем могут быть привлечены другие участники.
Почти 10 миллиардов баз будут секвенироваться в день в течение двухлетнего периода производства фаза. Это соответствует более чем двум человеческим геномам каждые 24 часа; новаторский потенциал. Бросая вызов ведущим специалистам в области биоинформатики и статистической генетики, набор данных о последовательностях будет включать 6 триллионов оснований ДНК, что в 60 раз больше данных о последовательностях, чем было опубликовано в базах данных ДНК за последние 25 лет. лет.
Для определения окончательного дизайна всего проекта были разработаны три пилотных исследования, которые будут выполнены в течение первого года реализации проекта. Первый пилотный проект предполагает генотипирование 180 человек из 3 основных географических групп при низком охвате (2x). Для второго пилотного исследования геномы двух ядерных семей (обоих родителей и взрослого ребенка) будут секвенированы с глубоким охватом (20x на геном). Третье пилотное исследование включает секвенирование кодирующих областей (экзонов) 1000 генов у 1000 человек с глубоким охватом (20x).
Было подсчитано, что проект, вероятно, будет стоить более 500 миллионов долларов, если стандартные технологии секвенирования ДНК были использованы. Поэтому будет применено несколько новых технологий (например, Solexa, 454, SOLiD ), что снизит ожидаемые затраты до 30-50 миллионов долларов. Основную поддержку будет оказывать Wellcome Trust Sanger Institute в Хинкстоне, Англия; Пекинский институт геномики, Шэньчжэнь (BGI Shenzhen), Китай; и NHGRI, часть Национального института здравоохранения (NIH).
В соответствии с принципами Форт-Лодердейла все данные последовательности генома (включая вызовы вариантов) являются в свободном доступе по мере развития проекта и может быть загружен по ftp с веб-страницы проекта 1000 геномов.
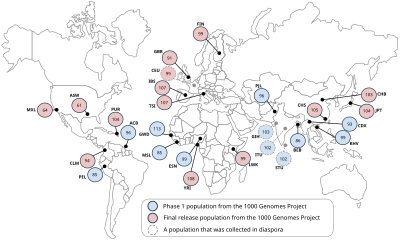 Расположение образцов населения проекта «1000 геномов». Каждый кружок представляет количество последовательностей в окончательном выпуске.
Расположение образцов населения проекта «1000 геномов». Каждый кружок представляет количество последовательностей в окончательном выпуске. Исходя из общих целей проекта, образцы будут выбраны для обеспечения достоверности в группах населения, где проводятся исследования ассоциаций для общих заболеваний.. Кроме того, образцы не обязательно должны содержать медицинскую информацию или информацию о фенотипе, поскольку предлагаемый каталог будет основным источником информации о человеческих вариациях.
Для пилотных исследований образцы генома человека из коллекции HapMap будут быть упорядоченным. Будет полезно сосредоточить внимание на образцах, по которым доступны дополнительные данные (например, последовательность ENCODE, генотипы по всему геному, последовательность fosmid на конце, анализы структурных вариаций и ген выражение ), чтобы можно было сравнить результаты с результатами других проектов.
В соответствии с обширными этическими процедурами, проект «1000 геномов» будет использовать образцы от добровольцев-доноров. В исследование будут включены следующие группы населения: йоруба в Ибадане (YRI), Нигерия ; японский в Токио (JPT); китайский в Пекин (CHB); Юта жители северной и западной Европы (CEU); Лухья в Вебуе, Кения (LWK); масаи в Кении (MKK); Тоскани в Италии (TSI); Перуанцы в Лиме, Перу (PEL); Индейцы гуджарати в Хьюстоне (GIH); Китайский в столичном Денвере (CHD); люди мексиканского происхождения в Лос-Анджелесе (MXL); и люди африканского происхождения на юго-западе Соединенных Штатов (ASW).
* Население tha Он был собран в диаспоре
Данные, полученные в рамках проекта «1000 геномов», широко используются генетическим сообществом, что делает первый проект «1000 геномов» одной из самых цитируемых статей в биологии. Чтобы поддержать это сообщество пользователей, в июле 2012 года в рамках проекта было проведено аналитическое собрание сообщества, на котором обсуждались ключевые открытия проекта, их влияние на популяционную генетику и исследования болезней человека, а также краткие сведения о других крупномасштабных исследованиях секвенирования.
Пилотная фаза состояла из трех проектов:
Было обнаружено, что в среднем каждый человек несет около 250–300 вариантов потери функции в аннотированных гены и 50-100 вариантов, ранее участвовавших в наследственных заболеваниях. Основываясь на этих двух трио, предполагается, что частота мутаций зародышевой линии de novo составляет примерно 10 на основание на поколение.