 | ||
 | ||
| Имена | ||
|---|---|---|
| Предпочтительное название IUPAC Пропан-1-ол | ||
Другие названия
| ||
| Идентификаторы | ||
| Номер CAS | ||
| 3D-модель (JSmol ) | ||
| 3DMet | ||
| Ссылка Beilstein | 1098242 | |
| ChEBI | ||
| ChEMBL |
| |
| ChemSpider | ||
| DrugBank | 100.000.679 | |
| Номер ЕС |
| |
| Ссылка на Гмелин | 25616 | |
| KEGG | ||
| MeSH | 1-пропанол | |
| PubChem CID | ||
| Номер RTECS |
| |
| UNII | ||
| Номер ООН | 1274 | |
| CompTox Dashboard ( EPA) | ||
InChI
| ||
УЛЫБКИ
| ||
| Свойства | ||
| Химическая формула | C3H8O | |
| Молярная масса | 60,096 г · моль | |
| Внешний вид | Бесцветная жидкость | |
| Запах | слабый, спирт -подобный | |
| Плотность | 0,803 г / мл | |
| Температура плавления | -126 ° C; -195 ° F; 147 K | |
| Температура кипения | от 97 до 98 ° C; От 206 до 208 ° F; От 370 до 371 K | |
| Растворимость в воде | смешиваемый | |
| log P | 0,329 | |
| Давление пара | 1,99 кПа (при 20 ° C) | |
| Кислотность (pK a) | 16 | |
| Основность (pK b) | −2 | |
| Магнитная восприимчивость (χ) | -45,176 · 10 см / моль | |
| Показатель преломления (nD) | 1,387 | |
| Вязкость | 1,959 мПа · с (при 25 ° C) | |
| Дипольный момент | 1,68 D | |
| Термохимия | ||
| Теплоемкость (C) | 143,96 Дж / (К · моль) | |
| Стандартная молярная. энтропия (S 298) | 192,8 Дж / (К · моль) | |
| Стандартная энтальпия образования. (ΔfH298) | -302,79… -302,29 кДж / моль | |
| Стандартная энтальпия. горения (ΔcH298) | -2,02156… -2,02106 МДж / моль | |
| Фармакология | ||
| Код АТХ | D08AX03 (ВОЗ ) | |
| Опасности | ||
| Пиктограммы GHS |    | |
| Сигнальное слово GHS | Опасно | |
| Краткая характеристика опасности GHS | H225, H318, H336 | |
| Меры предосторожности GHS | P210, P261, P280, P305 + 351 + 338 | |
| NFPA 704 (огненный алмаз) |  3 1 0 3 1 0 | |
| Температура вспышки | 22 ° C (72 ° F; 295 K) | |
| Самовоспламенение. температура e | 371 ° C (700 ° F; 644 K) | |
| Пределы взрываемости | 2,2–13,7% | |
| Смертельная доза или концентрация (LD, LC): | ||
| LD50(средняя доза ) | 2800 мг / кг (кролик, перорально). 6800 мг / кг (мышь, перорально). 1870 мг / кг (крыса, перорально) | |
| NIOSH (пределы воздействия на здоровье в США): | ||
| PEL (допустимо) | TWA 200 ppm (500 мг / м) | |
| REL (рекомендуется) | TWA 200 ppm (500 мг / м) ST 250 ppm (625 мг / м) [кожа] | |
| IDLH ( Непосредственная опасность) | 800 ppm | |
| Родственные соединения | ||
| Родственные соединения | Пропан. Изопропиловый спирт. Пропанамин. Этанол. Бутанол | |
| Страница дополнительных данных | ||
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая постоянная (εr) и т. Д. | |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ | |
| Спектральные данные | UV, IR, ЯМР, MS | |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа | ||
| Ссылки в информационном окне | ||
1-пропанол - это первичный спирт с формула CH. 3CH. 2CH. 2OH (иногда представлен как PrOH или n-PrOH ). Эта бесцветная жидкость также известна как пропан-1-ол, 1-пропиловый спирт, н-пропиловый спирт и н-пропанол <15.>. Это изомер из 2-пропанола (пропан-2-ол, изопропиловый спирт, изопропанол). Он образуется в небольших количествах естественным путем во время многих процессов ферментации и используется в качестве растворителя в фармацевтической промышленности, в основном для смол и сложных эфиров целлюлозы, а иногда и в качестве дезинфицирующего агента.
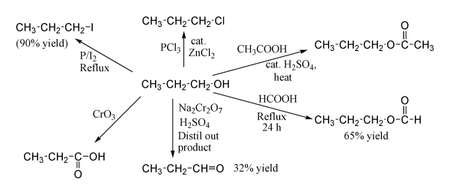 Некоторые примеры реакций 1-пропанола
Некоторые примеры реакций 1-пропанола 1-пропанола показывают нормальные реакции первичного спирта. Таким образом, его можно превратить в алкилгалогениды ; например, красный фосфор и йод дают н-пропилиодид с выходом 80%, а PCl. 3 с каталитическим нейтрализатором ZnCl. 2 дает н-пропилхлорид. Реакция с уксусной кислотой в присутствии катализатора H. 2SO. 4 в условиях этерификации Фишера дает пропилацетат при кипячении пропанола с обратным холодильником в течение ночи только с муравьиной кислотой можно получить пропилформиат с выходом 65%. Окисление 1-пропанола Na. 2Cr. 2O. 7 и H. 2SO. 4 дает только 36% выход пропиональдегида, и, следовательно, для этого типа реакции выше Рекомендуются методы получения с использованием PCC или окисления Сверна. Окисление хромовой кислотой дает пропионовую кислоту.
1-пропанол получают каталитическим гидрированием пропионового альдегида. Сам пропионовый альдегид производится с помощью оксо-процесса, гидроформилирования этилена с использованием моноксида углерода и водорода в присутствие катализатора, такого как октакарбонил кобальта или комплекс родия.
Традиционное лабораторное приготовление 1-пропанола включает обработку н-пропилиодид с влажным Ag. 2O.
1-пропанолом был открыт в 1853 году Густавом К.Б. Чанселем, который получил его фракционной перегонкой сивушного масла. Действительно, 1-пропанол является основным компонентом сивушного масла, побочного продукта, образующегося из определенных аминокислот, когда картофель или зерна ферментируются с получением этанола. Этот процесс больше не является значительным источником 1-пропанола.
Считается, что 1-пропанол аналогичен этанолу по своему действию на человеческий организм, но в 2–4 раза сильнее. Оральная LD 50 у крыс составляет 1870 мг / кг (по сравнению с 7060 мг / кг для этанола). Метаболизируется в пропионовую кислоту. Эффекты включают алкогольное опьянение и метаболический ацидоз с высоким анионным промежутком. По состоянию на 2011 год был зарегистрирован только один случай летального отравления 1-пропанолом.
1-пропанол имеет высокое октановое число и подходит для двигатель расход топлива. Однако производство пропанола было слишком дорогим, чтобы сделать его обычным топливом. октановое число по исследовательскому методу (RON) пропанола составляет 118, а антидетонационный индекс (AKI) составляет 108.